
| A. | 加热氯酸钾 | B. | 加热高锰酸钾 | C. | 电解水 | D. | 分离空气 |
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
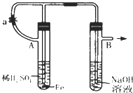 根据实验装置和下述操作,回答下列有关问题:
根据实验装置和下述操作,回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、KMnO4溶液、石蕊试液褪色 | |
| B. | 能使品红褪色的不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同 | |
| D. | 盐酸能使滴有酚酞的NaOH溶液褪色,所以盐酸也有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种金属物质的量相等 | B. | 三种金属均过量 | ||
| C. | 三种金属的质量相等 | D. | 盐酸均过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
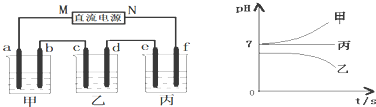
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
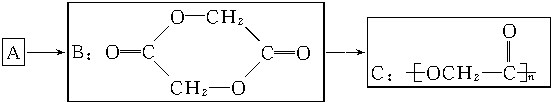
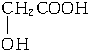 .
.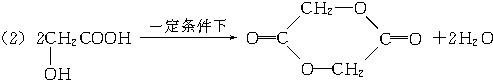 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com