
【题目】VCB是锂离子电池的一-种添加剂,以环氧乙烷(EO)为原料制备VCB的一种合成路线如下:
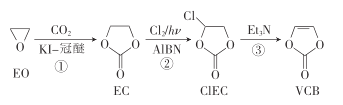
下列说法错误的是
A.反应①的原子利用率为100%
B.②的反应类型为取代反应.
C.EO、EC的一氯代物种数相同
D.CIEC、VCB分子中所有原子均处于同一平面
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2(降温后该反应的平衡常数变大)为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00×10﹣3 | 4.50×10﹣4 | 2.50×10﹣4 | 1.50×10﹣4 | 1.00×10﹣4 | 1.00×10﹣4 |
c(CO)(mol/L) | 3.60×10﹣3 | 3.05×10﹣3 | 2.85×10﹣3 | 2.75×10﹣3 | 2.70×10﹣3 | 2.70×10﹣3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)反应的Q___0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=___。
(3)计算在该温度下,反应的平衡常数K=___。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是___。
A.选用更有效的催化剂
B.升高反应体系的温度
C.降低反应体系的温度
D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | ___ | ___ | ___ | 124 |
Ⅲ | 350 | ___ | ___ | 124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①25℃时,NaHCO3溶液呈碱性,原因是___________水解引起的(填“Na+”或“HCO3-”);
②常温下,0.0100mol/L 盐酸的pH=___________;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为___________(填“蓝色”或“无色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1mol H2O(g)时放出241.8kJ 的热量,请完成该反应的热化学方程式:2H2(g) +O2(g)=2H2O(g) △H=___________kJ/mol;
②已知:C(石墨,s)=C(金刚石,s) △H>0,则稳定性: 石墨___________金刚石 (填“>”、“<”或“=”)。
(3)在某密闭容器中进行可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0,平衡常数表达式为K=
Fe(s)+CO2(g) △H>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________方向移动(填“正反应”或“逆反应”);
②若升高温度,平衡常数K___________(填“增大”、“减少”或“不变”);
③查阅资料得知1100℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________平衡状态(填“达到”或“未达到”)。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
①根据氧化还原反应:2Ag+(aq)+Cu(s)=2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液时__________溶液(填“CuSO4”或“AgNO3”);
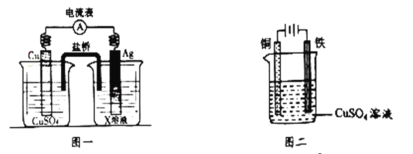
②图二装置在铁件上镀铜,铁作阴极,则铜极上的电极反应是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
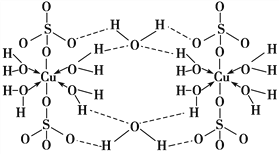
下列有关胆矾的说法正确的是( )
A. 所有氧原子都采取sp3杂化 B. 氧原子参与形成配位键和氢键两种化学键
C. Cu2+的价电子排布式为3d84s1 D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_________区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:_________。Mn2+的半径_________ Fe3+的半径(填“>”、“<”或“=”)。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为_________(用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_________;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为_________,H2O中氧原子的杂化方式为_________。
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H![]() )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则C5H![]() 的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
的大π键表示为________。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________(填标号)。
A 离子键 B 配位键 C σ 键 D 范德华力
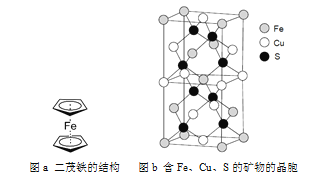
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为A pm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________ g/cm3(写出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是进行Mg与SiO2反应的实验装置,O2和H2O(g)的存在对该实验有较大影响。

下列说法不正确的是
A.装稀硫酸仪器的名称是分液漏斗,II中洗气瓶内是碳酸氢钠溶液
B.可以把装置I换成启普发生器
C.实验开始时,必须先通一段时间X气体,再在III处加热
D.当III处反应引发后,移走酒精灯,反应仍进行,说明该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、N及S的化合物用途非常广泛。回答下列问题;
(1)基态Fe原子价电子排布图为____;基态S原子的核外电子占据最高能级的电子云轮廓图为__________形。
(2)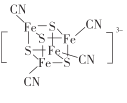 团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
团簇离子中,Fe2+、Fe3+数目之比为______;与铁形成配位键的原子是________,铁的配位数为_________。
(3)四氟铵可通过下列反应制备:NF3+F2 + BF3 =NF4 BF4
①NF3的空间构型为_____ , 中心原子的杂化方式是______。
②NF4BF4存在的作用力有________(填字母)。
A. σ键 B. π键 C.离子键. D.配位键
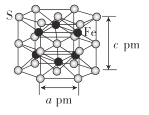
(4)Fe与S形成的一种化合物晶体的结构如图所示,六棱柱底边边长为a pm,高为c pm,阿伏加德罗常数的值为NA,该Fe、S化合物晶体的密度为_____(列出计算式)g. cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
完成下列填空:
28、有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式_______________;
写出甲醇分子中官能团的电子式_________________。
29、碳与同主族的短周期元素相比,非金属性较强的是_________(填元素符号)。写出一个能证明你的结论的化学方程式_____________________________________。
30、在温度和体积不变的情况下,能说明反应已达到平衡状态的是______(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
31、一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.40 | 0.16 | 0.16 |
Ⅱ | 387 | 0.80 | a | |
Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
(1)若要提高CH3OH的平衡转化率,可以采取的措施是______(选填编号)。
a.及时移走产物 b.升高温度 c.充入CH3OH d.降低温度
(2)I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为_____________(用含t的式子表示)。II号容器中a =___________mol。
32、若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向__________(填“正”“逆”)反应方向进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向1L0.1mol·L-1MgCl2和MnCl2溶液中加入Na2CO3,固体(忽略体积变化),如图为加入Na2CO3的物质的量与-1gc(Mg2+)或-lgc(Mn2+)之间的关系,已知常温下Ksp(MgCO3)>Ksp(MnCO3),下列说法正确的是( )
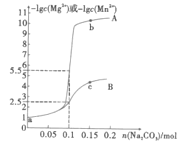
A.曲线A是n(Na2CO3)与-lgc(Mg2+)的关系曲线
B.Ksp(MnCO3)和Ksp(MgCO3)相差3个数量级
C.若将b点和c点溶液混合,存在![]() =1×106
=1×106
D.a点(MgCl2溶液)中存在:c(Mg2+)+c(H+)=c(OH-)+c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com