
| A. | NaClO3 | B. | NaCl | C. | ClO2 | D. | HCl |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1molCCl4的体积约为22.4L | |
| B. | 0℃、101KPa时,2g氢气的体积约为22.4L | |
| C. | 通常状况下,22.4LCO2中所含分子数为NA个 | |
| D. | 1mol气体的体积只有在标准状况下才约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的NaClO溶液中含有ClO-的数目小于NA | |
| B. | Na2O2与足量CO2反应生成1molO2,转移的电子数目为2NA | |
| C. | 两份2.7g铝分别与100mL浓度为2mol•L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA | |
| D. | 18g重水(D2O)所含的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
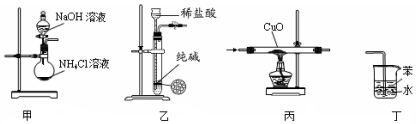
| A. | 用装置甲制取氨气 | B. | 用装置乙制取少量纯净的CO2气体 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收尾气氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质颗粒直径都在l~100nm之间 | B. | 都透过半透膜 | ||
| C. | 都是透明的澄清液体 | D. | 都呈红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
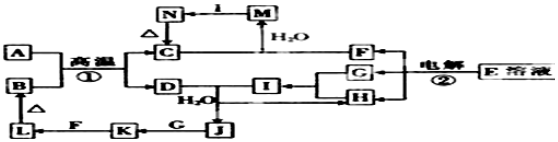
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑ | |
| B. | Fe3O4与过量的稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向Ba(OH)2溶液中逐滴加入NaHSO4溶液至Ba2+刚好沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | NaHS溶液呈碱性:HS-+H2O?H3O++OH-+S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com