
【题目】某同学以反应2Fe3++2I﹣2Fe2++I2为原理,研究浓度对氧化还原性和平衡移动的影响.实验如图1: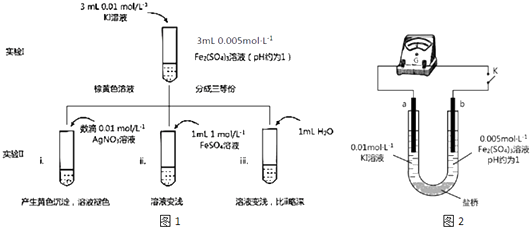
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 .
(2)iii是ii的对比试验,目的是排除有ii中造成的影响.
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化.用化学平衡移动原理解释原因: .
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原 因:外加Ag+使c(I﹣)降低,导致I﹣的还原性弱于Fe2+ , 用图2装置(a、b均为石墨电极)进行实验验证.①K闭合时,指针向右偏转,b作极.
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01molL﹣1 AgNO3溶液,产生的现象证实了其推测,该现象是 .
(5)按照(4)的原理,该同学用右图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因①转化原因是 .
②该实验与(4)实验对比,不同的操作是 .
(6)实验I中,还原性:I﹣>Fe2+;而实验II中,还原性:Fe2+>I﹣ , 将(3)和(4)、(5)作对比,得出的结论是 .
【答案】
(1)化学平衡状态
(2)溶液稀释对颜色变化的影响
(3)加入Ag+发生反应:Ag++I﹣=AgI↓,c(I﹣)降低;或c(Fe2+)增大,平衡均逆向移动
(4)正;左管产生黄色沉淀,指针向左偏转
(5)Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I﹣;向U型管右管中滴加1mol?L﹣1FeSO4溶液
(6)该反应为可逆氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动方向
【解析】解:(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到化学平衡状态,所以答案是:化学平衡状态;(2)根据实验iii和实验ii的对比可以看出是为了排除有ii中水造成溶液中离子浓度改变的影响,所以答案是:溶液稀释对颜色变化的影响;(3)i.加入AgNO3 , Ag+与I﹣生成AgI黄色沉淀,I﹣浓度降低,2Fe3++2I﹣ ![]() 2Fe2++I2平衡逆向移动, ii.加入FeSO4 , Fe2+浓度增大,平衡逆移,
2Fe2++I2平衡逆向移动, ii.加入FeSO4 , Fe2+浓度增大,平衡逆移,
所以答案是:加入Ag+发生反应:Ag++I﹣=AgI↓,c(I﹣)降低;或c(Fe2+)增大,平衡均逆向移动;(4)①K闭合时,指针向右偏转,b极为Fe3+得电子,作正极,所以答案是:正;
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01mol/L AgNO3溶液,产生黄色沉淀,I﹣离子浓度减小,2Fe3++2I﹣ ![]() 2Fe2++I平衡左移,指针向左偏转,所以答案是:左管产生黄色沉淀,指针向左偏转;(5)①Fe2+向Fe3+转化的原因是Fe2+浓度增大,还原性增强,所以答案是:Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I﹣;
2Fe2++I平衡左移,指针向左偏转,所以答案是:左管产生黄色沉淀,指针向左偏转;(5)①Fe2+向Fe3+转化的原因是Fe2+浓度增大,还原性增强,所以答案是:Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I﹣;
②与(4)实验对比,不同的操作是当指针归零后,向U型管右管中滴加1mol/L FeSO4溶液,所以答案是:向U型管右管中滴加1molL﹣1 FeSO4溶液; (6)将(3)和(4)、(5)作对比,得出的结论是在其它条件不变时,物质的氧化性和还原性与浓度有关,浓度的改变可影响物质的氧化还原性,导致平衡移动,所以答案是:该反应为可逆氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动方向.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变.下列说法正确的是( ) 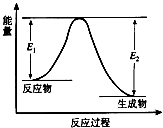
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H<0,反应达到平衡时,升高温度,A的转化率增大
D.△H>0,反应达到平衡时,升高温度,A的转化率减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
(1)Ⅰ.脱硝:已知:H2的燃烧热为285.8kJmol﹣1
N2(g)+2O2(g)=2NO2(g)△H=+133kJmol﹣1
H2O(g)=H2O(l)△H=﹣44kJmol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为
(2)Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2 , 在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)CH3OH(l)+H2O(l)
(I)①该反应自发进行的条件是(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 .
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H﹣H键断裂
(II)产物甲醇可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气.负极发生的电极反应式是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙酸的说法中不正确的是( )
A.乙酸易溶于水和乙醇
B.无水乙酸又称冰醋酸,它是纯净物
C.乙酸是一种重要的有机酸,是有强烈刺激性气味的液体
D.乙酸分子中有四个氢原子,所以不是一元酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验SO2气体中是否混有CO2的方法是( )
A.先通过足量澄清石灰水,再通过足量品红溶液
B.先通过足量饱和NaHCO3溶液,再通过澄清石灰水
C.先通过足量NaOH溶液,再通过澄清石灰水
D.先通过足量酸性KMnO4溶液,再通过澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食用醋中含有乙酸。下列关于乙酸的说法正确的是
A.结构简式为C2H4O2B.分子式为CH3COOH
C.分子中含有的官能团为羧基D.分子中原子之间只存在单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
A. Na2CO3是碳酸盐 B. Na2CO3是盐
C. Na2CO3是钠盐 D. Na2CO3是碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
(1)有科学家提出可利用FeO吸收和利用CO2 , 相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=﹣76.0kJmol一1
上述反应中每生成1mol Fe3O4 , 转移电子的物质的量为mol.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2 (g) C H4 (g)+2H2O(g),向一容积为2L的恒容密闭容器中充人一定量的CO2和H2 , 在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2molL一1 , H2 0.8molL一1 , CH40.8molL一1 , H2O1.6molL一1 . 则CO2的平衡转化率为300℃时上述反应的平衡常数K= . 200℃时该反应的平衡常数K=64.8,则该反应的△H(填“>’’或“<”)O.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgCl2、AlCl3的混合溶液中,开始滴加试剂X,之后改滴试剂Y,所得沉淀的物质的量n(mol)与试剂体积V(mL)间的关系如图所示。以下结论错误的是( )
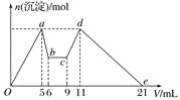
A. X是盐酸,Y是NaOH溶液,且c(Y)=2c(X)
B. 原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=1∶1∶5
C. X是NaOH溶液,Y是盐酸,且c(NaOH)∶c(HCl)=2∶1
D. 从7至9相应的离子方程式为H++OH-===H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com