
(12分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程脱硫实现了 (选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)过滤操作用到的玻璃仪器有: 。
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是 。
(4)写出KMnO4溶液加入到MnSO4溶液中制备MnO2的离子反应方程式: ;用惰性电极电解MnSO4溶液也可制得MnO2,其阳极的电极反应式是 。
(5)MnO2是碱性锌锰电池的电极材料,电池反应方程式为:2MnO2+Zn+H2O====2MnOOH+Zn(OH)2,写出该电池放电时,正极的电极反应式是 。
(1)A、C(2)烧杯、漏斗、玻璃棒
(3)消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀
(4)3Mn2++2 MnO4- +2H2O ====5MnO2+4H+ Mn2++2H2O-2e-====MnO2+4H+
(5)MnO2+H2O+e-====MnOOH+OH-
【解析】
试题分析:(1)白色污染主要是塑料等难降解的物质形成的,SO2能形成酸雨,因此脱硫实现了废弃物的综合利用,同时也减少了酸雨形成,即答案选AC。(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀。(3)已知:热化学方程式①Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol,②S(s)+O2(g)=SO2(g) △H=-297kJ/mol,③Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol,则根据盖斯定律可知③-(①+③)即得到SO2与MnO2反应生成无水MnSO4的热化学方程式MnO2(s)+SO2(g) =MnSO4(s) △H=-248kJ/mol。(4)电解池中阳极失去电子发生氧化反应,则用惰性电极电解MnSO4溶液可制得MnO2,因此阳极是锰离子放电,其阳极电极反应式是Mn2++2H2O-2e-=MnO2+4H+。(5)原电池中负极失去电子,正极得到电子,因此碱性锌锰电池放电时,正极是二氧化锰得到电子,则电极反应式是MnO2+H2O+e-=MnO(OH)+OH-。(6)实际参加反应的SO2的物质的量是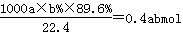 ,根据方程式MnO2(s)+SO2(g) =MnSO4(s)可知生成硫酸镁的物质的量是0.4abmol。最终生成二氧化锰是c kg,则根据方程式3MnSO4+2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4可知,因此消耗硫酸锰的物质的量是
,根据方程式MnO2(s)+SO2(g) =MnSO4(s)可知生成硫酸镁的物质的量是0.4abmol。最终生成二氧化锰是c kg,则根据方程式3MnSO4+2KMnO4+2H2O=5MnO2+K2SO4+2H2SO4可知,因此消耗硫酸锰的物质的量是 mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素的物质的量是
mol,则除去铁、铝、铜、镍等杂质时,所引入的锰元素的物质的量是 mol-0.4abmol,相当于二氧化锰的质量是(
mol-0.4abmol,相当于二氧化锰的质量是( mol-0.4abmol)×87g/mol=(600c-34.8ab)g=
mol-0.4abmol)×87g/mol=(600c-34.8ab)g= kg
kg
考点:考查物质制备工艺流程的有关判断与计算


科目:高中化学 来源:2014-2015学年内蒙古巴市高二10月月考化学试卷(解析版) 题型:选择题
如下图所示,△H1=-393.5 kJ?mol-1,△H2=-395.4 kJ?mol-1,下列说法或表示式正确的是

A.C(s,石墨)== C(s,金刚石) △H= +1.9 kJ?mol-1
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三上学期期中考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温条件下,11.2L甲烷气体含甲烷分子数为0.5NA
B.标准状况下,22.4L Cl2通入水中,反应过程中转移电子数为NA
C.常温条件下,0.1mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA
D.标准状况下,16g O2和O3的混合气体中含氧原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2 min后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省盐城市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是
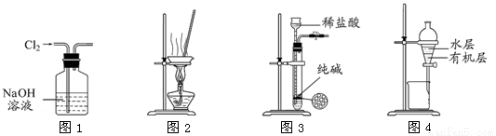
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:填空题
(12分)工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(已知Cd的金属活动性介于Zn和Fe之间)

(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。
该过程在空气入口处设计了一个类似淋浴喷头的装
置,其目的是 。
(4)置换法除去重金属离子Cd2+,所用物质C为 。
(5)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。
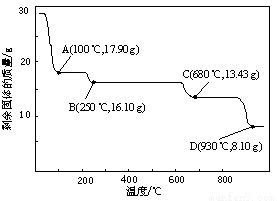
680℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省无锡市高三期中化学试卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
A.原子半径的大小顺序:rY> rX >rQ>rW
B.X、Y的最高价氧化物的水化物之间不能发生反应
C.Z元素的氢化物稳定性大于W元素的氢化物稳定性
D.元素Q和Z能形成QZ2型的共价化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省宿迁市高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
在研究金属钠与水反应的实验中,下列根据实验现象得出的结论不正确的是
A.将一小块Na投入水中,钠浮于水面,说明钠密度比水小
B.将一小块Na投入滴有酚酞的水中,溶液变红,说明反应生成了碱
C.将一小块Na投入CuSO4溶液中,生成蓝色沉淀,说明Na没有Cu活泼
D.点燃Na与肥皂水反应产生的气泡,有尖锐爆鸣声,说明有H2生成
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆复旦中学高一上学期期中化学试卷(解析版) 题型:选择题
在3NO2+H2O = 2HNO3+NO↑反应中,氧化剂与还原剂的分子数之比为
A.1∶2 B.2∶1 C.3∶1 D.1∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com