
)某有机物 X 的结构简式如下图所示,则下列有关说法中正确的是( )
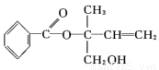
A.X的分子式为 C12H16O3
B.X在核磁共振氢谱图中共出现8组峰
C.X在一定条件下能发生加成、加聚、取代、氧化等反应
D.在Ni作催化剂的条件下,1 mol X 最多只能与5 molH2加成
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源:2016届内蒙古赤峰二中高三第四次模拟理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.拉瓦锡研究了空气的成分,让大家认识了氧气
B.右图为雾霾的主要成分示意图 ,汽车尾气的大量排放是造成雾霾天气的人因素之一
,汽车尾气的大量排放是造成雾霾天气的人因素之一
C.“滴水石穿、绳锯木断、落汤螃蟹着红袍”均不包含化学变化
D.“看似风平浪静,实则暗流涌动”形象地描述了溶解平衡的状态
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
设NA表示阿伏伽德罗常数的值,下列判断正确的是
A.将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
B.标准状况下,22.4 L甲醇中含有的C—H的数目为3NA
C.25℃时,pH=2的硫酸溶液中,含有的H+的数目为0.01NA
D.5.6 g Fe与一定量稀硝酸反应,Fe完全溶解时失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
下列实验目的对应的实验操作和实验原理均正确的是
实验目的 | 实验操作 | 实验原理 | |
A | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量硫酸溶液 | H+抑制FeCl3水解 |
C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | NH3溶于水后溶质的主要存在形式是NH4+、OH- |
D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 3Mg(OH)2+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期中化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.BF3、NF3分子的价层电子对互斥模型均为平面正三角形
B.H—Cl 的键能为431.8kJ/mol ,H—I 的键能为 298.7kJ/mol,这可以说明HCl分子比HI分子稳定
C.可燃冰是甲烷的结晶水合物,甲烷可与水形成氢键
D.因为N-H键能比P-H 大,所以NH3沸点比 PH3高
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:选择题
“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是____________________。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)硝酸铵在常温下比较稳定,但在强热的条件下会发生爆炸。可以得到一种无色气体和另一种红棕色的气体等物质,请写出该反应的方程式____________________;若标况下产生13mol的气体生成,则转移的电子的物质的量为________。
(3)硝酸铵和碱溶液反应生成的氨气,可以形成氨气——空气燃料电池。其反应原理为NH3+O2→N2+H2O(未配平),则电解质溶液应显____性(填“酸性”、“中性”或者“碱性”,负极的电极方程式为:______________。
(4)以TiO2为催化剂,可以用NaClO将CN-离子氧化成CNO-。在酸性条件下,NaCNO继续与NaClO反应生成N2、CO2、NaCl等。 请写出NaCNO在酸性条件下被NaClO氧化的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:选择题
将0.05mol某烃完全燃烧生成的产物依次通过浓硫酸和碱石灰,浓硫酸增重5.4克,碱石灰增重13.2克,该烃能使酸性高锰酸钾溶液褪色,若其结构中只含有一个亚甲基,则该烃的结构(不考虑立体异构)最多有
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟九化学试卷(解析版) 题型:选择题
五种短周期主族元素 A、B、C、D、E 的原子序数依次递增,A2属于绿色燃料,C的氧化物常用于玻璃的生产,D元素原子的核电荷数是同主族上一周期元素的2倍,B、C 为同周期元素,B、D 原子最外层电子数之和等于E的最外层电子数。 根据以上叙述,下列说法中正确的是
A.五种元素中B元素的金属性最强
B.元素D、E分别与元素A形成化合物的稳定性:A2D>AE
C.元素C、D、E的最高价氧化物对应水化物的酸性递减
D.元素B、D、E的简单离子半径大小为:B>D>E
查看答案和解析>>
科目:高中化学 来源:2016届青海省西宁市等校高三下联考理综化学试卷(解析版) 题型:选择题
下列溶液中粒子的物质的量浓度关系正确的是( )
A.NaH2PO4溶液PH<7,则在溶液中:c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-)
B.0.1mol·L-1(NH4)2SO4溶液与0.1mol·L-1NH3·H2O溶液等体积混合:
c(NH4+)+c(H+)=2c(SO42-)+c(OH-)
C.0.1mol·L-1CH3COONa溶液与0.1mol·L-1CH3COOH溶液等体积混合(pH<7)
c(CH3COOH) >c(Na+)>c(CH3COO-)>c(H+)
D.0.2mol·L-1NaHCO3溶液与0.1mol·L-1Na2CO3溶液等体积混合:
2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com