


科目:高中化学 来源:江苏省扬州中学2012届高三最后冲刺热身化学试题 题型:022
合成氨联产二甲醚是一项具有中国特色的化工工艺,具有节能环保,其工艺流程如下:
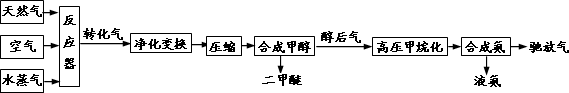
已知造气时,主要发生的反应有:CH4+H2O→CO+3H2………①;2CH4+O2→2CO+4H2………②.
CO、CO2均可与H2合成甲醇,合成甲醇后排出的醇后气中有很少量的CO、CO2,需与H2转化为甲烷,防止CO使合成氨催化剂中毒.
(1)已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1323 kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1;及CO的燃烧热:283 kJ·mol-1.
在一定条件下,CO、H2能生成二甲醚和气态水,该热化学方程式为________.(本题涉及的条件均在同一条件下)
(2)相同体积的天然气,采用“合成氨同时联产二甲醚”和直接合成氨相比,新工艺优越性有________.
a.减少二氧化硫排放
b.适应低碳经济
c.可提高氮肥产量
d.资源综合利用率和经济效益高
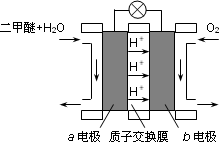
(3)下图为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为________.
(4)假定造气时产生的转化气中不含CO2,H2与CO物质的量之比为2.2,空气由80% N2和20% O2组成,天然气中CH4为100%,且①和②的转化率均为100%.则同温同压下通入的空气和水蒸气的体积比,V(空气)/V(水蒸气)=________.
(5)今有224 m3(已折合成标准状况)由CO、H2、N2组成的混合气体,分别合成甲醇和氨,且三种气体均完全转化,驰放气中甲烷忽略不计,若得到液氨34 kg,则同时得到二甲醚________千克?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com