
下列反应中,生成物总能量高于反应物总能量的是
A.乙醇燃烧 B.氧化钙溶于水
C.锌粉和稀硫酸反应 D.Ba(OH)2·8H2O和NH4Cl固体反应
科目:高中化学 来源: 题型:
[化学——选修5:有机化学基础](15分)
某香料W的结构简式如图所示。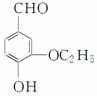
请按要求回答下列问题:
(1)有机物W中含氧不饱和官能团的名称为________。
(2)与有机物W互为同分异构体,能与NaHCO3溶液反应,且苯环上只有一个取代基的有_________________________________________________种(不含R—O—R′及R—O—COOH结构,R、R′代表烃基)。
(3)化合物Ⅱ是上述(2)同分异构体中的一种,可发生如下转化:
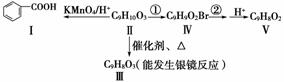
已知:与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基。
①写出化合物Ⅱ中含氧官能团的结构简式:________;
②由化合物Ⅱ也可直接生成化合物Ⅴ,设计反应①和②的目的是__________________________________________________________________。
③写出下列反应的化学方程式:
ⅰ.Ⅱ→Ⅲ:___________________________________________________;
ⅱ.化合物Ⅳ与NaOH水溶液共热:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年12月5日中国辽宁舰航母编队中的登陆舰紧急逼停了擅闯南海禁航区的美海军“考本斯”号导弹巡洋舰,避免了两军舰艇相撞。据悉,美国“考本斯”号巡洋舰上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)做载热介质。下列有关说法不正确的是( )
A.自然界中没有游离的钠和铝
B.若铝钠合金投入水中得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到水中,一定有偏铝酸钠生成
D.m g不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
 ①S8 分子中 S原子采用的轨道杂化方式sp3
①S8 分子中 S原子采用的轨道杂化方式sp3
②C2H4分子中只有以s轨道与sp2杂化轨道“头碰头”方式重叠而成的σ键
③SnBr2分子中Sn—Br的键角<120°
④H3O+中H-O-H键角比H2O中H-O-H键角大
A.①② B.③④ C.①②③ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为
A. B.
B.

C. D.
D.

查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A.凡是放热反应都是自发反应
B.凡是熵增大的反应都是自发反应
C.要判断反应进行的方向,必须综合考虑体系的焓变和熵变
D.过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
.在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:

Ⅰ:(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g) +CO2(g) CO(NH2)2 (l)+H2O(l).
CO(NH2)2 (l)+H2O(l).
① 已知该反应的平衡常数K195℃ < K165℃,则该反应的△H_______0(填“>”“=”或“<”)。
② 一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)/ n(CO2)=x,右图是氨碳比(x)与CO2平衡转化率(a)的关系。a随着x增大的原因是________。
③取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容
下充入气体He,CO(NH2)2(l)的质量_____(填“增加”、“减小”或“不变”)。
Ⅱ:(1)某温度下,纯水中c(H+) = 2.0×10-7mol/L,该温度下,0.9mol/L NaOH
溶液与0.1 mol/L HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的
pH=_________。
(2)向100 mL 0.10 mol/L CH3COOH的溶液中加入0.010 mol CH3COONa固体,溶
液pH增大,主要原因是(请用学过的平衡理论解释)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
| 序号 | 内容 |
|
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气 | 铁丝表面灰暗程度比 |
下列有关说法不正确的是( )
A.上述实验中已明显发生电化学腐蚀的实验是3、4、5、6
B.影响金属腐蚀的外部因素有湿度、温度、O2的浓度、电解质等
C.实验6中铁被腐蚀的程度比5严重是因铁发生了如下反应:Fe-2e-===Fe2+
D.若保持铁表面干燥或将锌与铁相连,可 起到保护铁制品的作用
起到保护铁制品的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com