
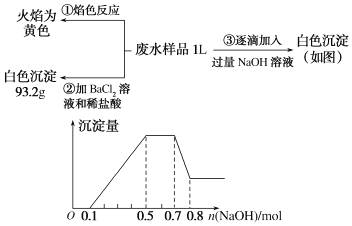
【题目】已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品1 L,进行了三组实验,其操作和有关图像如下所示:
请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是________,一定存在的阳离子是________。
(2)写出NH4+的电子式________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为____,所得沉淀的最大质量是___g。
(4)若通过实验确定原废水中c(Na+) =0.18 mol·L-1,试判断原废水中NO3-是否存在?________(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)=________ mol·L-1。(若不存在或不确定则此空不填)
【答案】CO32- Na+、H+、Al3+、Mg2+、NH4+  2:1 10.7 存在 0.08
2:1 10.7 存在 0.08
【解析】
无色废水确定无Fe3+,根据实验①确定有Na+,根据实验②确定有SO42-,根据实验③确定有Al3+,一定不含CO32-,故溶液中存在的离子为:Na+、H+、Al3+、Mg2+、NH4+,根据硫酸钡沉淀求出n(SO42-),根据图象求出n(Al3+)和n(H+),再根据电荷守恒确定有没有NO3-。
(1)根据实验①确定存在Na+,根据实验②确定存在SO42-,根据实验③图像确定有H+、Al3+、NH4+、Mg2+,没有Fe3+,因为CO32-与Al3+不能共存,所以无CO32-;故答案为:CO32-; Na+、H+、Al3+、Mg2+、NH4+;
(2)铵根是复杂阳离子,其电子式为: ,故答案为:
,故答案为: ;
;
(3)图象中横坐标0.7~0.8段发生反应Al(OH)3+OH-=AlO2-+2H2O,则生成氢氧化铝沉淀的物质的量为0.1mol;0.1~0.5段Al3+、Mg2+与NaOH反应生成Al(OH)3、Mg(OH)2沉淀,总共消耗0.4molNaOH,结合Al3++3OH-=Al(OH)3↓可知生成0.1molAl(OH)3消耗0.3molNaOH,n(Al3+)=0.1mol,根据Mg2++2OH-=Mg(OH)2↓可知生成Mg(OH)2沉淀消耗NaOH的物质的量为:0.4mol-0.3mol=0.1mol,所以n[Mg(OH)2]=![]() n(NaOH)=0.05mol,所得沉淀的最大质量是:78g/mol×0.1mol+58g/mol×0.05mol=10.7g,0.5~0.7段发生反应NH4++OH-=NH3H2O,n(NH4+)=0.2mol,在原溶液中c(NH4+)与c(Al3+)的比值为2:1,故答案为:2:1;10.7;
n(NaOH)=0.05mol,所得沉淀的最大质量是:78g/mol×0.1mol+58g/mol×0.05mol=10.7g,0.5~0.7段发生反应NH4++OH-=NH3H2O,n(NH4+)=0.2mol,在原溶液中c(NH4+)与c(Al3+)的比值为2:1,故答案为:2:1;10.7;
(4)0~0.1段发生反应H++OH-=H2O,则n(H+)=0.1mol,0.5~0.7段发生反应NH4++OH-=NH3H2O,n(NH4+)=0.2mol,生成的93.2g白色沉淀为硫酸钡,n(SO42-)=![]() =0.4mol,根据(2)可知,溶液中还会有n(Al3+)=0.1mol、n(Mg2+)=0.05mol,n(Na+)=0.18mol/L×1L=0.18mol,根据电荷守恒可知:c(NO3-)×1L=3n(Al3+)+2n(Mg2+)+n(Na+)+n(NH4+)+n(H+)-2n(SO42-)=0.1mol×3+0.05mol×2+0.18mol+0.1mol+0.2mol-0.4mol×2=0.08mol,则c(NO3-)=0.08molL-1,故答案为:存在;0.08。
=0.4mol,根据(2)可知,溶液中还会有n(Al3+)=0.1mol、n(Mg2+)=0.05mol,n(Na+)=0.18mol/L×1L=0.18mol,根据电荷守恒可知:c(NO3-)×1L=3n(Al3+)+2n(Mg2+)+n(Na+)+n(NH4+)+n(H+)-2n(SO42-)=0.1mol×3+0.05mol×2+0.18mol+0.1mol+0.2mol-0.4mol×2=0.08mol,则c(NO3-)=0.08molL-1,故答案为:存在;0.08。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:H2(g) + I2(g)![]() 2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ、Ⅲ中反应的平衡常数相同
C. 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
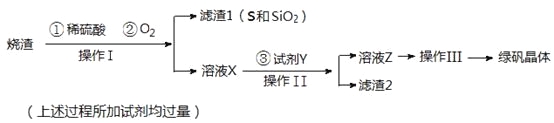 试回答:(1)操作Ⅰ为_____________(填写操作名称)。
试回答:(1)操作Ⅰ为_____________(填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为__________________________________。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是________________________________。
(4)操作Ⅲ的顺序依次为:_______________、冷却结晶、过滤 、__________、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需___________。
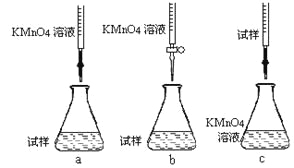
②该同学设计的下列滴定方式,最合理的是____________(夹持部分略去)(填字母序号)。
③滴定时发生反应的离子方程式为:_______________________________________。
④判断此滴定实验达到终点的方法是_____________________________;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果________(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将pH=l的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为_____。
(2)在25℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为___
(3)在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取Va L该盐酸,同该NaOH溶液中和,需Vb LNaOH溶液。填空:
①若a + b = 14,则Va∶Vb =_____(填数字)。
②若a + b = 13,则Va∶Vb =_______(填数字)。
③若a + b >14,则Va∶Vb =______(填表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。

化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
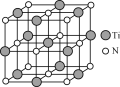
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。空气吹出法工艺,是目前“海水提漠”的最主要方法之一。其工艺流程如图所示,试回答下列问题:
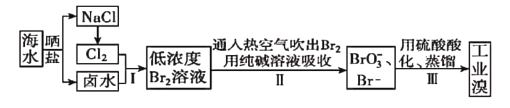
(1)以上步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是_____。
(2)步骤②通入热空气或水蒸气吹出![]() ,利用了溴的___。
,利用了溴的___。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:
![]() ____
____
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:____。
(5)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用足量的一氧化碳还原4.64 g某金属氧化物,把生成的二氧化碳全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此金属氧化物是下列中的( )
A. 氧化铜 B. 氧化铁 C. 四氧化三铁 D. 二氧化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论是干重还是鲜重,组成水生动物、人体细胞的元素中含量最多的四种元素是
A.O、N、H、CaB.O、Ca、P、Mg
C.C、O、N、HD.C、Fe、Ca、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com