
科目:高中化学 来源: 题型:选择题

| A. | 氧气、二氧化碳、氮气 | B. | 空气、水、氨水 | ||
| C. | 碳酸、高锰酸钾、过氧化氢 | D. | 金刚石、氢气、红磷 |
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:实验题
KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
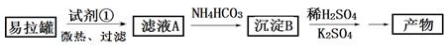
(1)为尽量少引入杂质,试剂①应选用 (填标号)。
A.HCl溶液 B.H2SO4溶液 C.氨水 D.NaOH溶液
(2)生成沉淀B的离子方程式为 ;明矾能用于净水,其原因是 ;往明矾溶液中滴加Ba(OH)2溶液,恰好使溶液中的SO42-完全沉淀的离子方程式为 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个固定容积的密闭容器中充入1mol N2和3mol H2使反应N2(g)+3H2(g)?2NH3(g)达到平衡,测得反应放出热量为Q1kJ.
N2与H2反应生成NH3的过程中能量变化曲线如图所示.若在一个固定容积的密闭容器中充入1mol N2和3mol H2使反应N2(g)+3H2(g)?2NH3(g)达到平衡,测得反应放出热量为Q1kJ.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2、KCl、CuSO4、NaNO3四种固体 | |
| B. | CCl4、乙醇、苯三种液体 | |
| C. | CaCO3、NaHSO4、Al2S3、Mg(OH)2四种固体 | |
| D. | NaCl、Na2SO4、AlCl3、MnO2四种固体 |
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期月考三化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是 ( )
A.工业上粗硅的制备:SiO2+C Si+CO2↑
Si+CO2↑
B.Cu2O与稀H2SO4反应:Cu2O+2H+=2Cu++H2O
C.用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO3-=3Ag++NO↑+2H2O
D .向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32-
.向Mg(HCO3)2溶液中加足量烧碱溶液:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
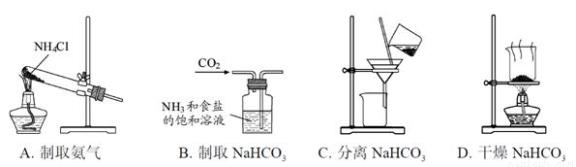
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com