
分析 反应中二氧化锰是催化剂,反应前后质量不变,利用反应前后固体混合物中二氧化锰的质量分数,求得反应一段时间后剩余固体的质量,利用质量守恒定律计算出反应放出氧气的质量,由反应的化学方程式中分解氯酸钾的质量与放出氧气的质量关系即可解答.
解答 解:设原混合物的质量为100g,则原混合物中二氧化锰的质量=100g×25%=25g,则原混合物中氯酸钾的质量为100g-25g=75g,
反应后固体混合物的质量为$\frac{25g}{30%}$=83.3g,
根据质量守恒定律计算出反应放出氧气的质量100g-83.3g=16.7g,
设疑分解的氯酸钾的质量为xg,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 96
x 16.7
则x=42.6g,即m(KClO3)=42.6g,所以氨酸钾的分解率$\frac{42.6g}{75g}×100%=56.8%$,
答:氨酸钾的分解率为56.8%.
点评 利用催化剂在反应前后质量不变,由二氧化锰的质量计算出反应后固体的质量,为解决本题的关键,本题题目难度中等.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾(K2FeO4)是一种新型高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 用SO2漂白纸浆和草帽辫,该过程利用了SO2的氧化性 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
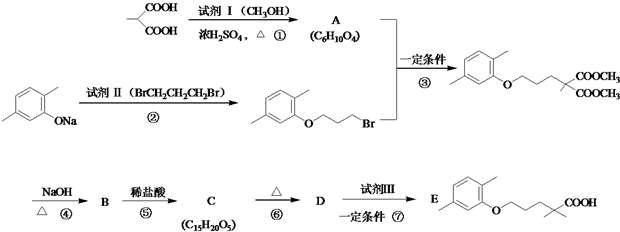
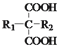 $\stackrel{△}{→}$
$\stackrel{△}{→}$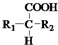 +CO2↑(R1和R2代表烷基)
+CO2↑(R1和R2代表烷基) $\stackrel{△}{→}$
$\stackrel{△}{→}$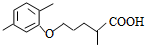 +CO2↑.
+CO2↑.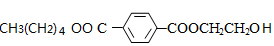 ,则X与Y发生缩聚反应所得缩聚物的结构简式是
,则X与Y发生缩聚反应所得缩聚物的结构简式是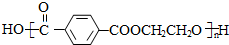 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )| A. | 开始时产生的气体为H2 | |
| B. | AB段发生的反应为置换反应 | |
| C. | 所用混合溶液中c(HNO3)=0.5 mol•L-1 | |
| D. | 参加反应铁粉的总质量m2=5.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 1.716 | 0.5 | 2.758 |
| 2 | 3.432 | 0.5 | |
| 3 | 5.148 | 0.5 | 8.274 |
| 4 | 6.864 | 0.5 | 11.032 |
| 5 | 8.580 | 0.5 | 11.032 |
| 6 | 10.296 | 0.5 | 11.032 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .用电子式表示D2C的形成过程
.用电子式表示D2C的形成过程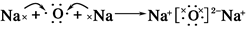 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com