
����Ŀ����1��Na+��Ne��Ϊ�ȵ����壬������I2��Na��___I1��Ne�����<���� ��=����>����.
��2�����������У���Alԭ��δ�ɶԵ�������ͬ�Ľ���Ԫ����___�֡���̬�Ȼ����ķ������Ϊ(AlCl3)2�������������Ļ�ѧ��������_______��Alԭ�ӵ��ӻ���ʽΪ____��

��3����ȼ������Ȼ��ˮ����������νṹ��ͼA�������С����ˮ���ӣ��ڲ��Ĵ����Ǽ�����ӣ���ˮ���ӳ�������������_________��ͼA����С�Ļ������ӵ�ԭ��������_________��
��ȼ��������ж�����״�ṹ������һ����1��ͼA��ʾ���ֱ���2����������������ͬ����������ɣ����м���ʵ��ռ��____________��ˮ���ӡ�
��4������þ������ԭ�ӵĶѻ���ʽΪ�������ܶѻ���ͼB��ʾ����������ͼC��ʾ�������þ��ԭ�Ӱ뾶Ϊa cm�������ĸ�Ϊb cm����þ���Ŀռ�������Ϊ__________��д������ʽ�����辧����A��ԭ�ӵ�����Ϊ��0��0��0����C��ԭ�ӵ�����Ϊ��2a��0��0����D��ԭ�ӵ�����Ϊ��0��0��b������B��ԭ�ӵ�����Ϊ__________________��

���𰸡� > 4 ���ۼ�����λ�� sp3 ��� 10 15 ![]()
![]()
����������1�������Ƶ������Խ�ǿ���Ժ�����ӵ����������ʸ�ǿ����ʧȥ������Ҫ���������������Ƶĵڶ������ܱ��ʵĸߣ���������I2��Na��>I1��Ne������2�����������У���Alԭ��δ�ɶԵ�������ͬ�Ľ���Ԫ����4�֡���̬�Ȼ����ķ������Ϊ(AlCl3)2�������������Ļ�ѧ�������й��ۼ�����λ����Alԭ�ӵ��ӻ���ʽΪsp3�ӻ�����3����ȼ������Ȼ��ˮ����������νṹ��ͼA�������С����ˮ���ӣ��ڲ��Ĵ����Ǽ�����ӣ���ˮ���ӳ������������������ͼA����С�Ļ������ӵ�ԭ��������10����ȼ��������ж�����״�ṹ������һ����1��ͼA��ʾ���ֱ���2����������������ͬ����������ɣ����м�����10��ˮ���Ӳ���̯�������������������棬��Ϊ������Σ�5��ˮ���ӣ���ʵ��ռ��10+5��2��![]() =15��ˮ���ӣ���4���������ܶѻ��ľ��������������ṹ�������ϡ�����������Ϊ���ܶѻ����ĸ�ԭ���������ɵ����Σ��߳�a = 2r���нǷֱ�Ϊ60�㡢120���������s =
=15��ˮ���ӣ���4���������ܶѻ��ľ��������������ṹ�������ϡ�����������Ϊ���ܶѻ����ĸ�ԭ���������ɵ����Σ��߳�a = 2r���нǷֱ�Ϊ60�㡢120���������s =![]() ��sin(60��)=
��sin(60��)= ![]() cm2�����������Ϊ
cm2�����������Ϊ![]() cm3��������������Ϊ��2��2��
cm3����������������2��2��![]() (
(![]() )3=
)3= ![]() a3=���ռ�������=
a3=���ռ�������= =
=![]() ��100%��
��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ����������ʯī������ʢ�б���NaCl��Һ��U�ι��У�

��1����K1�պϣ�ʯī����Χ��ҺpH���ߣ���缫��ӦʽΪ___________________��
��2����K2�պϣ������������μӷ�̪�Ժ�ɫ��������______________________����ƽ���ƶ�ԭ�����ͣ���
��3����K2�պϣ������ܷ�Ӧ�����ӷ���ʽΪ________________________________��
��. ��ˮ���ۺ����ÿ����Ʊ�����þ�;��Σ���������ͼ��ʾ��
��1������a�У��ܽ⡢���ˡ����������ζ�Ҫ�õ���һ�ֲ���������________��
��2��ΪʹĸҺ�е�Mg2+��ȫת��ΪMg��OH��2������Ũ��С��10��5molL��1ʱ�������ʹ���ȫ��������b����Һ��pH����Ҫ������___________���������£�Mg(OH)2��Ksp=1��10��11��
��3������c�������Ȼ�������ķ�Χ�м�������������ɣ����û�ѧ����ʽ��ʾ�����Ȼ��������²���������ˮMgCl2��ԭ��_________________________________��
��4����ɲ���d�Ļ�ѧ����ʽ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڽ������ϵ�˵���У�����ȷ���ǣ�
A. �Ͻ�ֻ������Ԫ�� B. ���������������;���ĺϽ�
C. ���Ͻ�һ��ȴ�����Ӳ�ȴ� D. ��ͭ������ʹ�õĺϽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ҿ�����Ⱦ����Ҫ��Դ֮һ������ʹ�õ�װ�β��ϡ����ϰ塢��ǽͿ�ϻ��ͷų�һ�ִ̼�����ζ���塣�������ǣ� ��
A. ���� B. ��ȩ C. ���� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����칤����м�������˪(As2O3) ����ȡ:���������¾�(ע: �ڵ�������) ��Ҥ����ʯ���ϣ�������ͻ(ע: ��Ͳ)��������������ͻ�ڡ�������̿�ٻ�����������ͻ��Ѭ�����ϡ��������漰�IJ���Ϊ
A. ���� B. ���� C. ���� D. ��ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������жϴ������
A. �ȶ��ԣ�NH3>PH3>AsH3
B. ԭ�Ӱ뾶��N>P>As
C. ���ԣ�HClO4>H2SO4>H3PO4
D. ���ԣ�NaOH>Mg(OH)2>Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ƽ���ҽ���ϳ�������������ۣ���һ�ֺϳ�·�����£�
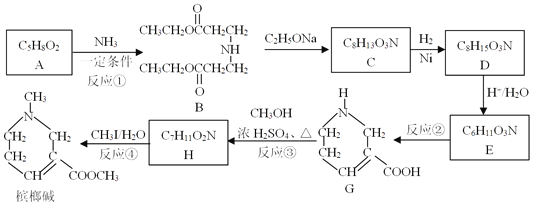
��֪�������ͻ������백��NH3����R��NH2����Ӧ�������µİ������
�磺![]()
II��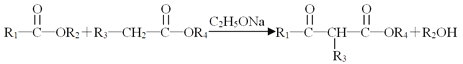
��1��B�к��������ŵ�����Ϊ______________��
��2����Ӧ�ٵķ�Ӧ����Ϊ____________����Ӧ�ڵķ�Ӧ����Ϊ______________��
��3����Ӧ�۵Ļ�ѧ����ʽΪ_____________________��
��4��C�Ľṹ��ʽΪ__________��
��5������˵����ȷ����____________������ĸ����
a����Ӧ��Ϊȡ����Ӧ
b�����Ƽ��뻯����G��Ϊͬϵ��
c��1 mol D�������2 mol NaOH������Ӧ
��6����֪A��NaOH��Һ��ˮ��IJ���֮һ��һ�������ܸ߷��Ӳ��ϣ�PAANa���ĵ��壬д������PAANa�Ļ�ѧ����ʽ__________________________��
��7����֪��CH2=CHCH3 ��Cl2 ![]() CH2=CHCH2Cl��HCl���Ա�ϩ���Ҵ�Ϊ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�A��д���ϳ�·��____________���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
CH2=CHCH2Cl��HCl���Ա�ϩ���Ҵ�Ϊ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�A��д���ϳ�·��____________���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йذ����ӵ�����NA��������ȷ����
A. 1molCl2�μӷ�Ӧ����һ���õ�2NA������
B. ��״���£���22.4LNO��11.2LO2��Ϻ��Եõ�NA��NO2����
C. ���³�ѹ�£�1L0.1mol/LHF��Һ�к���0.1NA��H+
D. 25 ����1.7g�ǻ�����������ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ����ú����ˮ����Na2S2O35H2O��ԭ����S+Na2SO3![]() Na2S2O3��Na2SO3�Թ���)��ʵ���ҿ�������װ�ã���ȥ���ּӳ�������ģ�����ɹ��̡�
Na2S2O3��Na2SO3�Թ���)��ʵ���ҿ�������װ�ã���ȥ���ּӳ�������ģ�����ɹ��̡�

��1������A�в�������Ļ�ѧ����ʽΪ______________________��
��2��װ��B��������________________________________________��
��3��ʵ���У�ΪʹSO2��������װ��C�����õIJ�����____________________��װ��C���Ʊ���Ӧ������������_________________________________��
��4��װ��C�е���Һ��һ������ڼ��Ի����������Ʒ���ƣ������ӷ�Ӧ����ʽ��ʾ��ԭ��________________________________________________��Ϊ����װ��C�г����ܳ��ֵ�Na2SO4���ʣ��ڲ��ı�ԭ��װ�õĻ�����Ӧ��ȡ�IJ�����___________________����Ӧ��������C�еĻ�����Һ��________(��д��������)���ᾧ�����ˡ�ϴ�ӡ�����õ���Ʒ��
��5��װ��D���ڴ���β������ѡ�õ������װ�ã��г���������ȥ��Ϊ______������ţ���

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com