
表中原子化热、晶格能、键能的单位都是kJ·mol-1
|
金属 |
金属原子化热 |
离子化合物 |
晶格能 |
共价键 |
键能 |
|
Na |
108.4 |
NaCl |
786 |
Cl-Cl |
243 |
|
Mg |
146.4 |
NaBr |
747 |
Si-Si |
176 |
|
Al |
326.4 |
MgO |
3791 |
Si-Cl |
360 |
则下列说法正确的是( )
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:2012-2013学年浙江省高三第一次统练化学试卷(解析版) 题型:选择题
表中原子化热、晶格能、键能的单位都是kJ·mol-1
|
金属 |
金属原子化热 |
离子化合物 |
晶格能 |
共价键 |
键能 |
|
Na |
108.4 |
NaCl |
786 |
Cl-Cl |
243 |
|
Mg |
146.4 |
NaBr |
747 |
Si-Si |
176 |
|
Al |
326.4 |
MgO |
3791 |
Si-Cl |
360 |
则下列说法正确的是( )
A.Na(s)与Cl2(g)反应生成1molNaCl(s)放出的热量为556.1kJ
B.Si(s)+2Cl2(g)=SiCl4(g) △H=-602kJ·mol-1
C.从表中可以看出,氯化钠的熔点比晶体硅高
D.从表中数据可以看出,微粒半径越大金属键、离子键的越弱,而共价键却越强
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
表中原子化热、晶格能、键能的单位都是kJ·mol-1
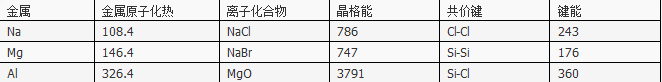
则下列说法正确的是
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
查看答案和解析>>
科目:高中化学 来源:2013届浙江省台州中学高三第一次统练化学试卷(带解析) 题型:单选题
表中原子化热、晶格能、键能的单位都是kJ·mol-1
| 金属 | 金属原子化热 | 离子化合物 | 晶格能 | 共价键 | 键能 |
| Na | 108.4 | NaCl | 786 | Cl-Cl | 243 |
| Mg | 146.4 | NaBr | 747 | Si-Si | 176 |
| Al | 326.4 | MgO | 3791 | Si-Cl | 360 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com