
 以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )
以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体体积V (g)(标准状况)的关系如图所示.下列说法中,正确的是( )| A. | 电解前CuSO4溶液的物质的量浓度为2mol/L | |
| B. | 电解后所得溶液中c(H+)=2mol/L | |
| C. | 当n(e-)=0.6mol时,V(H2):V(O2)=2:3 | |
| D. | 向电解后的溶液中加入16gCuO,则溶液可恢复为电解前的浓度 |
分析 石墨电极电解200mL CuSO4溶液,先发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,后发生2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,结合图象可知,生成2.24L气体时转移0.4mol电子发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,以此来计算解答.
解答 解:A.由生成2.24L气体时转移0.4mol电子发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,则n(CuSO4)=$\frac{2.24L}{22.4L/mol}$×2=0.2mol,c(CuSO4)=$\frac{0.2mol}{0.2L}$=1mol/L,故A错误;
B.生成2.24L气体时转移0.4mol电子,当转移0.4mol电子时,生成n(H2SO4)=0.2mol,c(H+)=$\frac{0.2mol×2}{0.2L}$=2mol/L,随电解的进行,水继续电解,溶剂减小,则电解后所得溶液中c(H+)>2mol/L,故B错误;
C.当n(e-)=0.6mol时,发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑~4e-,n(H2)=$\frac{0.2mol×2}{4}$=0.1mol,n(O2)=0.1mol+0.05mol=0.15mol,所以V(H2):V(O2)=0.1mol:0.15mol=2:3,故C正确;
D.因电解后从溶液中析出Cu、氧气、水,则加入16gCuO不会恢复为电解前的浓度,故D错误;
故选C.
点评 本题考查电解原理及计算,明确发生的电解反应及图象中体积与转移电子的关系即可解答,注意从溶液中析出Cu、氧气、水结合电解反应中转移的电子数来计算,题目难度中等.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
 .
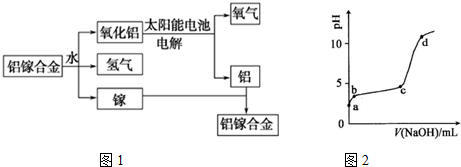
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶质的电离方程式为NaHSO3═Na++H++SO32- | |
| B. | c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(HSO3-)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
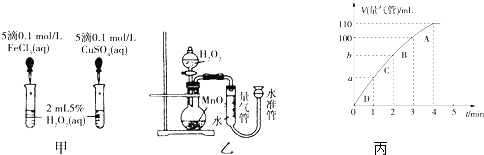
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
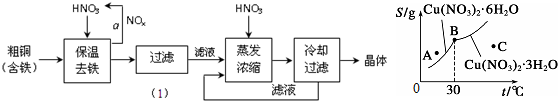
| A. | C点溶液为Cu(NO3)2的不饱和溶液 | |
| B. | 30℃时结晶可析出两种晶体 | |
| C. | 按上述流程最终得到的晶体是Cu(NO3)2•3H2O | |
| D. | 将A点溶液升温至30℃时,可以析出Cu(NO3)2•3H2O晶体. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe 2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
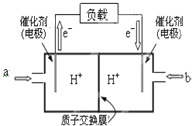 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量与白色固体的质量均保持不变 | |
| B. | 溶液浓度和pH值均保持不变,溶液下部是1.73g氢氧化钡固体 | |
| C. | 溶液中钡离子与氢氧根离子的数目均保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 | |
| D. | 溶液中钡离子与氢氧根离子的物质的量的浓度保持不变,${\;}^{1{8}^{\;}}$O存在于溶液和固体中,固体质量大于1.73克 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com