
某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
(1)溶液变为血红色 (2)Fe2+、Cu2+
(3)3Fe2++4H++NO3-=3Fe3++NO↑+2H2O (4)160.0g
解析试题分析:若向原溶液中加入KSCN溶液,无明显变化,这说明溶液中没有铁离子。若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,因此溶液中一定含有氯离子。能产生气泡的只能是NO3-在酸性条件下被还原生成NO,因此一定还含有还原性离子亚铁离子,同时还含有NO3-。③若向溶液中加入BaCl2溶液,有白色沉淀生成,这说明还含有SO42-。由于离子的物质的量均为1mol,则根据溶液的电中性可知,溶液中一定还含有阳离子。由于只能含有5种离子,则根据阴离子的电荷数是4mol可知,另外一种阳离子是铜离子。
(1)在酸性条件下NO3-能把Fe2+氧化生成Fe3+,所以若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是溶液变为血红色。
(2)根据以上分析可知,原溶液中含有的阳离子是Fe2+、Cu2+。
(3)加入盐酸,具有氧化性的NO3-和还原性的Fe2+发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。
(4)原溶液中所含阳离子是Fe2+、Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是CuO、Fe2O3,根据题意各离子的物质的量均为1mol可知,m(CuO)=1mol×80g/mol=80g,m(Fe2O3)=0.5mol×160g/mol=80g,所得固体的质量为80g+80g=160.0g。
考点:考查离子检验、鉴别、氧化还原反应的书写以及有关计算


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:填空题
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示。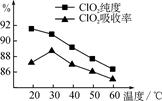
(1) 据图可知,反应时需要控制的适宜温度是________℃,要达到此要求需要采取的措施是______________。
(2) 已知:黄铁矿中的硫元素在酸性条件下可被ClO3-氧化成SO42-,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
(3) 该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+=Cl-+5Fe3++2H2O
14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有以下物质:①Al;②稀硫酸;③NaHCO3;④液氨;⑤盐酸;⑥蔗糖溶液;⑦无水乙醇;⑧熔融NaOH;⑨NaHSO4;⑩CO2,回答下列问题(用相应物质的序号填写)
(1)可以导电的有 ;
(2)属于非电解质的有 ;
(3)请写出③的电离方程式 ;
(4)写出⑧中的物质的溶液与⑨的溶液反应的离子方程式 ;
(5)写出①与⑧中的物质的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)下列物质: ①蔗糖 ②Br2 ③Na2O ④Ba(OH)2 ⑤CO2 ⑥SO3
⑦NaCl溶液 ⑧NaCl ⑨HCl ⑩H2SO4
属于电解质的是 , 属于非电解质的是 ,能导电的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
学校附近的湖水中浮萍疯长,助长水质恶化。湖水水样中可能含有Fe3+、Ba2+、K+、H+、NO3-、Cl-、CO32-、SO42-离子。为了进一步确认,取样进行实验检测:
①取水样仔细观察,呈透明、均一状态。
②用pH试纸测定污水的pH,试纸显红色。
③向水样中滴入KSCN溶液,呈红色。
④向水样中滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
(1)由此可知,该污水中肯定含有的离子是_________,肯定没有的离子是_________。
(2) 浮萍疯长的可能原因是水中含有较多的_____________离子。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物质 | 需加入的试剂 | 有关离子方程式 |
| (1)HNO3(H2SO4) | | |
| (2)Cu(Fe) | | |
| (3)NaCl(Na2CO3) | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某溶液含有K+、Cu2+、Fe3+、Al3+、Fe2+、Cl—、CO2—3、OH—、NO—3、SO2—4中的几种,已知该溶液中各离子物质的量浓度均为0.2mol/L(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:
I.取少量溶液,加入KSCN溶液时无明显变化:
Ⅱ.取原溶液加入BaCl2溶液,有白色沉淀生成;
Ⅲ.另取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类没有增加。
请推断:
(l)仅由操作I及现象可得出的结论是____。
(2)仅由操作Ⅱ及现象可得出的结论是____。
(3)由操作Ⅲ及现象可得出溶液中一定含有的阳离子是____(写离子符号)。操作Ⅲ中发生反应的化学方程式为____。
(4)结合三步操作及题干已知,你认为原溶液中所含离子种类共有____种。
(5)另取l00mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g,写出此过程中涉及氧化还原反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”, S2O32-与Cl2反应的产物之一为SO42一。下列说法中,错误的是 ( )
| A.该反应中的氧化剂是C12 |
| B.SO2与氯水的漂白原理相同,所以可用S02做纺织工业的漂白剂 |
| C.上述反应中,每生成1 mol SO42一,可脱去2 mol C12 |
| D.根据该反应可判断还原性:S2O32->C1— |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com