
ijČÜŅŗÓÉNa£«”¢Cu2£«”¢Ba2£«”¢Fe3£«”¢£”¢HCO ”¢SO
”¢SO ”¢Cl£ÖŠµÄČōøÉÖÖĄė×Ó×é³É”£Č”ŹŹĮæøĆČÜŅŗ½ųŠŠČēĻĀŹµŃé£ŗ
”¢Cl£ÖŠµÄČōøÉÖÖĄė×Ó×é³É”£Č”ŹŹĮæøĆČÜŅŗ½ųŠŠČēĻĀŹµŃé£ŗ
¢ŁĻņĘäÖŠ¼ÓČė¹żĮæŃĪĖį£¬ÓŠĘųĢå²śÉś£¬²¢µĆµ½ĪŽÉ«ĶøĆ÷ČÜŅŗ£»¢ŚĻņ¢ŁĖłµĆČÜŅŗÖŠ¼ÓČė¹żĮæ°±Ė®£¬²śÉś°×É«³Įµķ£¬¹żĀĖ£»¢ŪĻņ¢ŚĖłµĆČÜŅŗÖŠ¼ÓČė¹żĮæĒāŃõ»Æ±µČÜŅŗ£¬²śÉś°×É«³Įµķ£¬¹żĀĖ£»¢ÜĻņ¢ŪĖłµĆµÄĀĖŅŗÖŠ¼ÓČė¹żĮæĻ”ĻõĖį£¬ŌŁ¼ÓČėĻõĖįŅųČÜŅŗ£¬²śÉś°×É«³Įµķ”£
øł¾ŻÉĻŹöŹµŃé»Ų“šĻĀĮŠĪŹĢā”£
(1)ŌČÜŅŗÖŠŅ»¶Ø²»“ęŌŚµÄĄė×ÓŹĒ__________£»
(2)ŌČÜŅŗÖŠŅ»¶Ø“ęŌŚµÄĄė×ÓŹĒ__________”£
½āĪö””ÓÉ¢ŁæÉÖŖŌČÜŅŗÖŠÓŠHCO £¬ĪŽCu2£«”¢Fe3£«£»¾Ż¢ŚæÉÖŖŌČÜŅŗÖŠÓŠ££¬££«4H£«===Al3£«£«4H2O£¬Al3£«£«3NH3·H2O===Al(OH)3”ż£«3NH
£¬ĪŽCu2£«”¢Fe3£«£»¾Ż¢ŚæÉÖŖŌČÜŅŗÖŠÓŠ££¬££«4H£«===Al3£«£«4H2O£¬Al3£«£«3NH3·H2O===Al(OH)3”ż£«3NH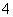 £»¾Ż¢ŪæÉÖŖŌČÜŅŗÖŠÓŠSO
£»¾Ż¢ŪæÉÖŖŌČÜŅŗÖŠÓŠSO £¬ĪŽBa2£«£»¾Ż¢ÜÖŖ¢ŪĖłµĆĀĖŅŗÖŠŗ¬ÓŠCl££¬µ«ŹĒŌŚ¢Ł²Ł×÷ÖŠ¼ÓČėŃĪĖįŅŃŅżČėĮĖCl££¬ĖłŅŌ²»ÄÜÅŠ¶ĻŌČÜŅŗÖŠŹĒ·ńŗ¬ÓŠCl£”£øł¾ŻČÜŅŗ³ŹµēÖŠŠŌ£¬ČÜŅŗÖŠÓŠŅõĄė×Ó£¬±ŲÓŠŃōĄė×Ó£¬ĖłŅŌÄĘĄė×ÓŅ»¶Ø“ęŌŚ”£
£¬ĪŽBa2£«£»¾Ż¢ÜÖŖ¢ŪĖłµĆĀĖŅŗÖŠŗ¬ÓŠCl££¬µ«ŹĒŌŚ¢Ł²Ł×÷ÖŠ¼ÓČėŃĪĖįŅŃŅżČėĮĖCl££¬ĖłŅŌ²»ÄÜÅŠ¶ĻŌČÜŅŗÖŠŹĒ·ńŗ¬ÓŠCl£”£øł¾ŻČÜŅŗ³ŹµēÖŠŠŌ£¬ČÜŅŗÖŠÓŠŅõĄė×Ó£¬±ŲÓŠŃōĄė×Ó£¬ĖłŅŌÄĘĄė×ÓŅ»¶Ø“ęŌŚ”£
“š°ø””(1)Cu2£«”¢Ba2£«”¢Fe3£«
(2)£”¢HCO ”¢SO
”¢SO ”¢Na£«
”¢Na£«



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½«äåĖ®·Ö±šÓė¾Ę¾«”¢¼ŗĻ©”¢¼ŗĶéŗĶĖÄĀČ»ÆĢ¼ĖÄÖÖŹŌ¼Į»ģŗĻ£¬³ä·ÖÕńµ“ŗó¾²ÖĆ£¬ĻĀĮŠĻÖĻóÓėĖł¼ÓŹŌ¼Į²»ĻąĪĒŗĻµÄŹĒ(””””)
| A | B | C | D | |
| ÓėäåĖ®»ģŗĻµÄŹŌ¼Į | ¾Ę¾« | ¼ŗĻ© | ¼ŗĶé | ĖÄĀČ»ÆĢ¼ |
| ĻÖĻó |
|
|
|
|
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ąė×Ó¾§ĢåŅ»°ć²»¾ßÓŠµÄĢŲÕ÷ŹĒ(””””)
A£®ČŪµć½Ļøß”¢Ó²¶Č“ó
B£®Ņ×ČÜÓŚĖ®¶ųÄŃČÜÓŚÓŠ»śČܼĮ
C£®øÉŌļŹ±²»Äܵ¼µē
D£®ČŪ»ÆŹ±²»µ¼µē
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚ0.01 mol·L£1 H2SO4ČÜŅŗÖŠ£¬Ė®µēĄė³öµÄH£«ÅضČĪŖ(””””)
A£®1”Į10£12 mol·L£1 B£®1”Į10£7 mol·L£1
C£®5”Į10£13 mol·L£1 D£®5”Į10£12 mol·L£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĖįÓźŹĒŅņĪŖ¹ż¶ČČ¼ÉÕĆŗŗĶŹÆÓĶ£¬Éś³ÉĮņµÄŃõ»ÆĪļ¼°µŖµÄŃõ»ÆĪļČÜÓŚĖ®¶ųÉś³ÉĮņĖįŗĶĻõĖįµÄŌµ¹Ź”£Ä³“ĪÓźĖ®µÄ·ÖĪöŹż¾ŻČēĻĀ£ŗ
c(NH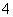 )£½2.0”Į10£5 mol·L£1£¬c(Cl£)£½6.0”Į10£5 mol·L£1£¬c(Na£«)£½1.9”Į10£5 mol·L£1£¬
)£½2.0”Į10£5 mol·L£1£¬c(Cl£)£½6.0”Į10£5 mol·L£1£¬c(Na£«)£½1.9”Į10£5 mol·L£1£¬
c(NO )£½2.3”Į10£5 mol·L£1£¬c(SO
)£½2.3”Į10£5 mol·L£1£¬c(SO )£½2.8”Į10£5 mol·L£1”£
)£½2.8”Į10£5 mol·L£1”£
ŌņøĆĖįÓźµÄpHĪŖ(””””)
A£®5.6 B£®4.3
C£®5 D£®4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
æÉÄę·“Ó¦£ŗA(g) 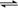 B(g)£¬Ęä·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēĻĀĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
B(g)£¬Ęä·“Ó¦¹ż³ĢÖŠÄÜĮæ±ä»ÆČēĻĀĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
£ØŅŌEa±ķŹ¾»ī»ÆÄÜ£¬Ea(Õż)”¢Ea(Äę)·Ö±š±ķŹ¾Õż”¢Äę·“Ó¦»ī»ÆÄÜ£©
A£®øĆ·“Ó¦µÄ ¦¤H = Ea(Õż) £ Ea(Äę)
B£®øĆ·“Ó¦µÄEa(Õż) = E3 £ E2
C£®Ö»ŅŖĪĀ¶ČÉżøߣ¬øĆæÉÄę·“Ó¦¾Ķ»įĻņÄę·“Ó¦·½Ļņ½ųŠŠ
D£®æÉÄę·“Ó¦B(g) 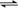 A(g)µÄ¦¤H = E2 £ E1
A(g)µÄ¦¤H = E2 £ E1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀ±ķÖŠĖłŹ¾ĪļÖŹ»ņøÅÄī¼äµÄ“ÓŹō¹ŲĻµ·ūŗĻČēĶ¼µÄŹĒ
|
| X | Y | Z |
| A | ÄĘŌŖĖŲ | Ö÷×åŌŖĖŲ | ¶ĢÖÜĘŚŌŖĖŲ |
| B | µē½āÖŹ | »ÆŗĻĪļ | “æ¾»Īļ |
| C | ĒāŃõ»ÆĢś | ½ŗĢå | ·ÖÉ¢Ļµ |
| D | ÖĆ»»·“Ó¦ | Ńõ»Æ»¹Ō·“Ó¦ | ·ÅČČ·“Ó¦ |

| ”” | A£® | A | B£® | B | C£® | C | D£® | D |
””
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Ļņ100mLµÄFeBr2ČÜŅŗÖŠĶØČė±ź×¼×“æöĻĀCl25.04L£¬Cl2Č«²æ±»»¹Ō£¬²āµĆČÜŅŗÖŠc£ØBr©£©=c£ØCl©£©£¬ŌņŌFeBr2ČÜŅŗµÄĪļÖŹµÄĮæÅØ¶ČŹĒ£Ø””””£©
| ”” | A£® | 0.75mol/L | B£® | 1.5mol/L | C£® | 2mol/L | D£® | 3mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
½ńÓŠøß¾ŪĪļ
 ¶Ō“Ė·ÖĪöÕżČ·µÄŹĒ(””””)
¶Ō“Ė·ÖĪöÕżČ·µÄŹĒ(””””)
A£®ĖüŹĒŅ»ÖÖĢåŠĶøß·Ö×Ó»ÆŗĻĪļ

²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com