
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
【答案】C
【解析】A项中,NaHC2O4溶液中存在电离平衡:HC2O4—![]() C2O42—+H+;还存在水解平衡:HC2O4—+H2OH2C2O4+OH-,由于溶液显酸性,故电离程度大于水解程度,所以c(C2O42—)>c(H2C2O4),正确。B项中,等式关系是物料守恒,NaHC2O4溶液中Na+的总量等于与草酸相关物质的总量,正确。C项中,因为等式左边全是正电荷,等式右边全是负电荷,若是电荷守恒,则c(C2O42—)的系数应是2,错误。D项中,等式是质子守恒,可以由电荷守恒c(Na+)+c(H+)=c(HC2O4—)+2c(C2O42—)+c(OH-)与物料守恒c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)相减而得,正确。
C2O42—+H+;还存在水解平衡:HC2O4—+H2OH2C2O4+OH-,由于溶液显酸性,故电离程度大于水解程度,所以c(C2O42—)>c(H2C2O4),正确。B项中,等式关系是物料守恒,NaHC2O4溶液中Na+的总量等于与草酸相关物质的总量,正确。C项中,因为等式左边全是正电荷,等式右边全是负电荷,若是电荷守恒,则c(C2O42—)的系数应是2,错误。D项中,等式是质子守恒,可以由电荷守恒c(Na+)+c(H+)=c(HC2O4—)+2c(C2O42—)+c(OH-)与物料守恒c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)相减而得,正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】严重的雾霾天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。
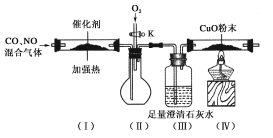
(1)装置(Ⅲ)的主要作用为________________________。
(2)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是___________________。
(3)该套装置中有不完善之处,还应在装置(Ⅳ)后补充____________。
(4)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3===NaNO2+NaNO3+CO2、NO2+NO+Na2CO3===2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为________。Na2CO3溶液的物质的量浓度为________mol·L-1(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】范德华力为a kJ·mol-1,化学键为b kJ·mol-1,氢键为c kJ·mol-1,则a、b、c的大小关系正确的是
A. a>b>cB. b>a>cC. c>b>aD. b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置。

请回答下列问题:
(1)仪器a的名称为_________;装置A的圆底烧瓶中盛放的固体物质可选用__________(填序号)。
a.氯化钠 b.氢氧化钠 c.碳酸钙
(2)装置F的圆底烧瓶中发生反应的离子方程式为___________;装置E的洗气瓶中盛放的试剂为 ____________。
(3)反应过程中,装置C的集气瓶中有大量白烟产生,另一种产物为空气的主要成分之一,该反应的化学方程式为 _________。
(4)从装置C的b处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 ________溶液的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和乙醇的混合气体VL,完全燃烧后生成二氧化碳和水,消耗相同状态下的氧气3VL,则混合气体中乙烯和乙醇的体积比是( )
A. 1∶1B. 2∶1C. 1∶2D. 任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,不能按 ![]() (“―→”表示反应一步完成)关系转化的是( )
(“―→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种气态烃.完全燃烧时产生的水和二氧化碳的物质的量之比为1:1.A的相对分子质量小于30.在下图变化中,中间产物C能和新制的氢氧化铜反应生成砖红色沉淀.(反应条件未写出)
又知2CH3CHO+O2![]() 2CH3COOH.请回答下列问题:
2CH3COOH.请回答下列问题:
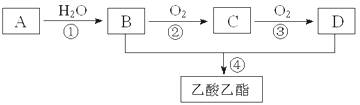
(1)写出A的电子式________
(2)B、D分子内含有的官能团分别是________、________(填名称);
(3)判断下列反应的反应类型:①______________,③______________
(4)写出下列反应的化学方程式:②________________________________________;
(5)下列说法正确的是________。
A.有机物B与金属钠反应,现象是钠浮在液面,不停的游动,最后消失。
B.有机物B、D以及乙酸乙酯可用饱和Na2CO3溶液鉴别
C.反应④中,浓硫酸主要起氧化作用
D.有机物C能被新制碱性氢氧化铜悬浊液、酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)CO和NO2是汽车尾气的主要污染物.汽车尾气的反应式之一为:2NO(g)+2CO(g)═N2(g)+2CO2(g).请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
2C(s)+O2═2CO(g)△H=﹣221kJ/mol
则2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=______.
(2)一定温度下,在一体积为VL的密闭容器中充入一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=a mol、n(NO)=2a mol、n(N2)=b mol,且N2占平衡混合气体总价体积的1/4.
①该反应的平衡常数K=______(用只含a、V的式子表示)
②判断该反应达到平衡的标志是______(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0mol NO、2.4mol CO通入固定容积2L的密闭容器中,反应过程中部分物质的物质的量变化如图一所示,

则①有害气体NO的转化率是______,0~15min CO2的平均反应速率v(CO2)=______②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是______(填序号)
A.增加CO2的量 B.加入催化剂 C.降低温度 D.扩大容积体积
(4)通过NOX传感器可监测NOX的含量,其工作原理如图二所示,
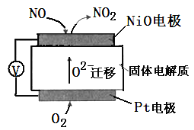
则①Pt电极上发生的是______反应(填“氧化”或“还原”)②NiO电极上的电极反应式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B. 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C. 0.1mol/LNa2CO3溶液:c(OH-)=c(H2CO3)+c(HCO3-)+c(H+)
D. 对于反应2SO2+O2![]() 2SO3,使用催化剂能加快反应速率和提高SO2平衡转化率
2SO3,使用催化剂能加快反应速率和提高SO2平衡转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com