
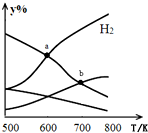
 以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | |
| B. | b点,v正(CO2)=v逆(H2O) | |
| C. | a点,H2和H2O物质的量相等 | |
| D. | 其他条件恒定,充入更多H2,v(CO2)不变 |
分析 A、平衡常数仅与温度有关;
B、b点时反应物仍然减小,生成物仍然增大,说明平衡向正反应方向进行;
C、根据图象分析,a点为H2和H2O物质的量的交点;
D、其他条件恒定,充入更多H2,增大反应物的浓度则正反应速率增大,所以v(CO2)也增大.
解答 解:A、因为平衡常数仅与温度有关,该反应为放热反应,升高温度平衡向逆反应移动,所以温度越低,K越大,所以Ka>Kb,故A错误;
B、b点时反应物仍然减小,生成物仍然增大,说明平衡向正反应方向进行,所以v正(CO2)≠v逆(H2O),故B错误;
C、根据图象分析,a点为H2和H2O物质的量的交点,所以相等,故C正确;
D、其他条件恒定,充入更多H2,增大反应物的浓度则正反应速率增大,所以v(CO2)也增大,故D错误;
故选:C.
点评 本题考查平衡移动原理、平衡常数的判断等,难度中等,注意判断曲线表示哪一物质的体积分数是关键,侧重考查学生对图象的分析与平衡移动的理解,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | HCl的酸性比HBr强 | |
| B. | 次氯酸的氧化性比次溴酸强 | |
| C. | 氯化氢比溴化氢的热稳定性好 | |
| D. | 氯原子最外层电子数比溴原子最外层电子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题.
随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 |
| ① | 将少量氯水滴入盛有少量NaBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② | 将少量溴水滴入盛有少量KI溶液的试管中, 振荡;再滴入少量四氯化碳,振荡 | 加入溴水后,溶液由无色变为褐色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被-C3H7取代,所得产物有6种 | |
| B. | 与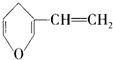 互为同分异构体的芳香族化合物有4种 互为同分异构体的芳香族化合物有4种 | |
| C. | 已知丁基共有四种.不必试写,立即可断定分子式为C5H10O的醛应有4种 | |
| D. | 菲的结构简式为 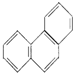 ,一定条件下它与硝酸反应,最多可生成5种一硝基取代物 ,一定条件下它与硝酸反应,最多可生成5种一硝基取代物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com