
| A. | ③⑤ | B. | ①③ | C. | 仅有⑤ | D. | ②④ |
分析 ①碳酸钠溶液与盐酸,前者过量生成碳酸氢钠和氯化钠,后者过量生成氯化钠、水和二氧化碳;
②偏铝酸钠溶液与盐酸,根据氢氧化铝的两性分析,生成的氢氧化铝可以溶解在强酸中;
③二氧化碳和氢氧化钠反应生成碳酸钠,碳酸钠和过量二氧化碳反应也可以生成碳酸氢钠;
④硝酸银溶液与氨水反应,氨水多时生成银氨溶液,氨水少时生成氢氧化银沉淀;
⑤Al(OH)3不溶于过量的氨水.
解答 解:①碳酸钠溶液与盐酸,前者过量,反应为:CO32-+H+=HCO3-;后者过量,即碳酸钠少量,发生反应为:CO32-+2H+=CO2↑+H2O,所以量不同,反应不同,故①错误;
②偏铝酸钠溶液与盐酸反应,前者过量,反应为:AlO2-+H++H2O═Al(OH)3↓产生白色沉淀,后者过量发生AlO2-+H++H2O═Al(OH)3↓,Al(OH)3+3H+═Al3++3H2O,量不同,生成产物不同,故②错误;
③氢氧化钠溶液中通入二氧化碳反应生成碳酸钠,CO2+2OH-=CO32-+H2O,碳酸钠和过量二氧化碳反应生成碳酸氢钠,与量有关,OH-+CO2=HCO3-,故③错误;
④硝酸银中滴氨水是银氨溶液的配制,先产生白色氢氧化银沉淀,继续滴加,形成配合物银氨络离子(银氨溶液)使沉淀溶解.先发生:Ag ++NH3•H2O=AgOH↓+NH4+,后发生:AgOH+2NH3•H2O=[Ag(NH3)2]++OH-+2H2O;氨水中滴硝酸银,一开始就产生银氨溶液(氨水过量),量不同,生成产物不同,故④错误;
⑤Al(OH)3不溶于过量的氨水,所以与量无关,离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3 NH4+,故⑤正确.
故选C.
点评 本题考查离子方程式的书写,关键是熟练掌握离子的性质和产物与过量试剂的后续反应的性质,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收足量的SO2气体:2OH-+SO2═SO32-+H2O | |
| B. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| D. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
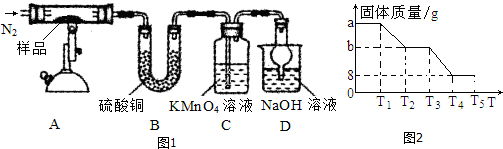
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| B. | 清洁能源所用光电池的生产材料主要是用高纯度的二氧化硅 | |
| C. | 在医疗上氢氧化铝可用于治疗胃酸过多 | |
| D. | 漂白粉在使用时一定要加入一定量的盐酸才能起到漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
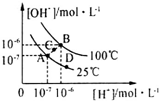
| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3•H2O)的值逐渐减小 | |
| C. | 在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | 100℃时,0.05mol•L-1 H2SO4溶液的pH≠1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度时水溶液碱性:NaHCO3>Na2CO3 | |
| B. | 热稳定性:NaHCO3>Na2CO3 | |
| C. | 与盐酸溶液反应的速率(快慢):NaHCO3<Na2CO3 | |
| D. | 等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,NaHCO3产生的CO2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
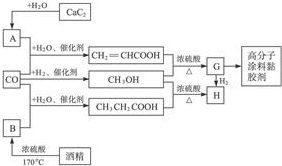
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com