
 ,故答案为:Cl2;
,故答案为:Cl2; ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 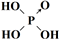 | 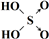 |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
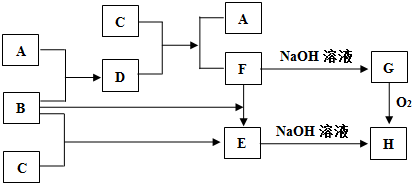
 A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴人沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E.它们之间的转化关系如图,下列推断正确的是( )
A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴人沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E.它们之间的转化关系如图,下列推断正确的是( )| A、物质B是H2 |
| B、物质C是Cl2 |
| C、物质D是FeCl2 |
| D、物质F是FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 1mol?L-1的Na2CO3 溶液中含有CO32-的数目为NA |
| B、常温常压下,22.4 L CH4中含有4 NA 个C-H键 |
| C、常温常压下,1.7gH2O2中含有的电子数为0.5 NA |
| D、1 mol Zn与足量稀HNO3反应,转移2NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com