
 ��
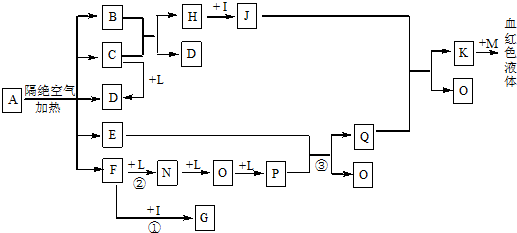
������ ����K��M��Ӧ����Ѫ��ɫ��Һ��˵��K������������Һ��M����ɫ��Ӧ��MΪ��ɫΪKSCN��IΪ��������ǿ��Ϊ����HCl������FNOP��ת����ϵ�����ƶ�LΪO2��E���³�ѹ��Ϊ��ɫ��ζ��Һ���ƶ�ΪH2O����Ӧ�ٳ���������F�ļ��飬F��I��HCl����Ӧ��˵��FΪNH3��GΪNH4Cl��F��������Ӧ���ɵĵ���NΪN2��OΪNO��PΪNO2��QΪHNO3������J�����ᷴӦ���ɵ�K���Ƿ���������ԭ��Ӧ�Ľ����H��I��HCl����Ӧ�ƶ�HΪFe��JΪFeCl2������е���Ϣ��CD������ɫ���壬B+C=Fe+D����������˵���÷�Ӧ�ǻ�ԭ����ԭ�������������ɣ������ж�CΪCO��DΪCO2��BΪ���������B����Ԫ�ص���������Ϊ22.2%����BΪFeO�������жϳ������ʽ��з����ش����⣮
��� �⣺����K��M��Ӧ����Ѫ��ɫ��Һ��˵��K������������Һ��M����ɫ��Ӧ��MΪ��ɫΪKSCN��IΪ��������ǿ��Ϊ����HCl������FNOP��ת����ϵ�����ƶ�LΪO2��E���³�ѹ��Ϊ��ɫ��ζ��Һ���ƶ�ΪH2O����Ӧ�ٳ���������F�ļ��飬F��I��HCl����Ӧ��˵��FΪNH3��GΪNH4Cl��F��������Ӧ���ɵĵ���NΪN2��OΪNO��PΪNO2��QΪHNO3������J�����ᷴӦ���ɵ�K���Ƿ���������ԭ��Ӧ�Ľ����H��I��HCl����Ӧ�ƶ�HΪFe��JΪFeCl2������е���Ϣ��CD������ɫ���壬B+C=Fe+D����������˵���÷�Ӧ�ǻ�ԭ����ԭ�������������ɣ������ж�CΪCO��DΪCO2��BΪ���������B����Ԫ�ص���������Ϊ22.2%����BΪFeO��
��1��DΪCO2������ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��2����Ӧ���ǰ����Ĵ���������Ӧ�Ļ�ѧ��Ӧ����ʽ��4NH3+3O2=2N2+6H2O�� ��Ӧ���Ƕ���������ˮ��Ӧ����һ�����������ķ�Ӧ�����ݷ���ʽ��֪3NO2+H2O=NO+2HNO3���������ͻ�ԭ�������ʵ���֮��Ϊ1��2��
�ʴ�Ϊ��4NH3+3O2=2N2+6H2O��1��2��
��3��FΪNH3��GΪNH4Cl�������������Ũ�ȵ�G��F����Һ��ϣ���Һ�Լ��ԣ�˵����ˮ�ĵ���̶ȴ���笠����ӵ�ˮ��̶ȣ�������Һ������Ũ�ȴӴ�С��˳��Ϊ c��NH4+����c��Cl-����c��OH-����c��H+����
�ʴ�Ϊ��c��NH4+����c��Cl-����c��OH-����c��H+����
��4��JΪFeCl2������J�������ӵ�ʵ�鷽��Ϊȡ������Ʒ���Թ��У��ȼ���KSCN�����������ټ���������ˮ��Һ���ֺ�ɫ��
�ʴ�Ϊ��ȡ������Ʒ���Թ��У��ȼ���KSCN�����������ټ���������ˮ��Һ���ֺ�ɫ��
��5��A�ڸ������������·ֽ�����ĸ���������ʵ���֮��ΪB��C��D��E��F=1��2��2��2��2����FeO��CO��CO2��H2O��NH3=1��2��2��2��2������ԭ���غ�ͻ��ϼ۴�����Ϊ0������ƶ����������ʵ������ƶϳ�A�Ļ�ѧʽΪ����NH4��2Fe��C2O4��2��
�ʴ�Ϊ����NH4��2Fe��C2O4��2��
���� ���⿼��������ת����ϵ���������ʵ��ۺ�Ӧ�ã���Ҫ����������仯�������ʵ��ۺ�Ӧ�á�������ԭ��Ӧ�����ԭ����Ӧ�á���ѧ����ʽ����д����ѧʽ�ļ���ȷ������Ŀ�Ѷȴ�


 ������ÿ�ʱ�Ż���ҵϵ�д�
������ÿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ƽ��ȡ15.80g NaCl���� | |
| B�� | ��10mL��Ͳ��ȡ6.25 mLϡ���� | |
| C�� | �þ���pH��ֽ���ij��Һ��pHΪ4.2 | |
| D�� | ���к͵ζ�ʵ��ʱ����50mL������ʽ�ζ���ȥȡ17.90mL���ռ���Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ں������ʵ�����FeBr2��FeI2����Һ�л���ͨ��Cl2��I-��Br-��Fe2+ | |
| B�� | �ں������ʵ�����Fe3+��Cu2+��H+����Һ�м���Zn��Fe3+��Cu2+��Fe2+��H+ | |
| C�� | �ں������ʵ�����Ba��OH��2��KOH����Һ��ͨ��CO2��Ba��OH��2��KOH��K2CO3��BaCO3 | |
| D�� | �������ʵ�����AlO2-��OH-��CO32-��Һ�У���μ������AlO2-��Al��OH��3��OH-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ȼ���BaCl2��Һ���ټ���������HCl��Һ�������˰�ɫ��������Һ��һ�����д�����SO42- | |
| B�� | ����������CaCl2��Һ�������˰�ɫ��������Һ��һ�����д�����CO32- | |
| C�� | ��������Ũ NaOH��Һ�������˴���ǿ�Ҵ̼�����ζ�����壮��Һ��һ�����д�����NH4+ | |
| D�� | �ȼ����������Ὣ��Һ�ữ���ټ�AgNO3��Һ�������˰�ɫ��������Һ��һ�����д�����Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
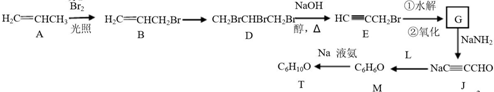
 ����T�Ľṹ��ʽΪ
����T�Ľṹ��ʽΪ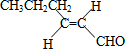 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
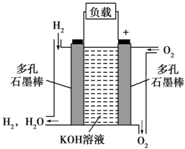 ��ͼ��ʾΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��������ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز����������Իش��������⣺
��ͼ��ʾΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��������ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز����������Իش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com