
分析 设参加反应的CO为xmol,则
2H2(g)+CO(g)?CH3OH(g)
开始 6 3 0
转化 2x x x
6s 6-2x 3-x x
6秒末时容器内压强为开始时的0.6倍,则
$\frac{6-2x+3-x+x}{6+3}$=0.6,
解得x=1.8,以此来解答.
解答 解:设参加反应的CO为xmol,则
2H2(g)+CO(g)?CH3OH(g)
开始 6 3 0
转化 2x x x
6s 6-2x 3-x x
6秒末时容器内压强为开始时的0.6倍,则
$\frac{6-2x+3-x+x}{6+3}$=0.6,
解得x=1.8,
(1)H2的反应速率是$\frac{\frac{2×1.8mol}{0.5L}}{6s}$=1.2 mol•L-1•s-1,答:H2的反应速率是1.2 mol•L-1•s-1;
(2)CO的转化率为$\frac{1.8}{3}$×100%=60%,答:CO的转化率为60%;
(3)化学平衡常数K=$\frac{(\frac{1.8mol}{0.5L})}{(\frac{6mol-2×1.8mol}{0.5L})^{2}×(\frac{3mol-1.8mol}{0.5L})}$=0.065( mol•L-1)-2,答:化学平衡常数为0.065( mol•L-1)-2.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率和转化率的计算等为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,题目难度中等.


科目:高中化学 来源: 题型:实验题
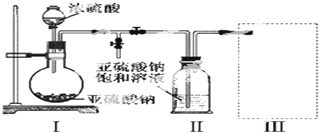
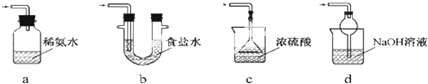
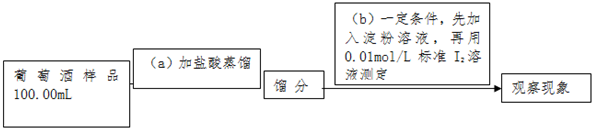
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
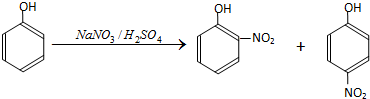
| 密度 (g•mL-1) | 熔点 (℃) | 沸点 (℃) | 溶解性 | 其他 | |
| 邻硝基苯酚 | 1.495 | 44.45 | 214 | 微溶于冷水,易溶于热水 | 能与水蒸气一同挥发 |
| 对硝基苯酚 | 11.481 | 113.4 | 279 | 稍溶于水 | 不与水蒸气一同挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 家用电器起火,常用液态CO2灭火,一般不用液态四氯化碳 | |
| B. | 将一氧化碳中毒者移到通风处抢救 | |
| C. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 | |
| D. | 实验后,剩余的药品不能随便丢弃(或浪费),应放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入标准状况下HCl气体11.2L,可使1 L浓度为0.5mol/L的盐酸物质的量浓度增大到1mol/L | |
| B. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OH- | |
| C. | 将10g碳酸钙粉末加水配成100mL溶液,CaCO3物质的量浓度为1mol/L | |
| D. | 4g NaOH溶解在10mL水中,再稀释成1L,从中取1mL,这1mL溶液的物质的量浓度为0.1mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com