
(8分)(1)已知离子反应: +6I—+6H+=R—+3I2+3H2O,n=_____,R元素在
+6I—+6H+=R—+3I2+3H2O,n=_____,R元素在 中的化合价是___ __。
中的化合价是___ __。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: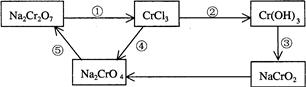
①在上述有编号的步骤中,需用还原剂的是_______,需用氧化剂的是 。 (填编号)。
②标出下面化学方程式电子转移的方向和数目(用双线桥表示),并回答有关问题
Na2Cr2O7+6KI+14HCl = 2CrCl3+2NaCl+6KCl+3I2+7H2O
反应中的还原剂___________。
(10分)(1)(1) n=1,+5。(2)① ①, ④。
②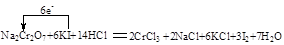 还原剂:KI
还原剂:KI
解析试题分析:(1)根据电荷守恒可知,n=1,所以R元素在 中的化合价是+(2×3-1)=+5价。
中的化合价是+(2×3-1)=+5价。
(2)①还原剂在反应中失去电子,而氧化剂是得到电子的。根据转化图可知,反应①中Cr的化合价是是降低的,需要加入还原剂;反应②、③和⑤中Cr元素化合价是不变的,不是氧化还原反应;反应④中Cr元素的化合价升高,需要加入氧化剂。
②根据方程式可知,Cr元素的化合价从+6价降低到+3价,得到3个电子,被还原,作氧化剂。碘元素的化合价从-1价升高到0价,失去1个电子,被氧化。作还原剂。
考点:考查氧化还原反应的有关判断、氧化还原反应的表示等
点评:判断氧化还原反应的依据是化合价的升降,而电子的得失是氧化还原反应的本质。所以判断氧化还原反应的关键是准确标出有关元素的化合价,然后分析即可。


科目:高中化学 来源: 题型:
完成下列各题
(1)将一定量镁粉逐渐投入饱和FeCl3的黄色溶液中,首先看到溶液变成红褐色,并产生气
泡;后来有少量的红褐色沉淀生成。请回答下列问题:
①红褐色溶液是 ,气泡的成分是 。
②用简洁的文字和反应方程式解释该实验的现象
(2)已知KSP(Fe(0H)3)==1.25×10-38,KSP(Mg(OH)3)=1.8×10-11,当溶液中某离子的浓度小于1×10-5mol.L-1时,可认为该离子已沉淀完全。又知:lg2=0.3,lg5=0.7,则在Fe3+和Mg2+的浓度均为0.1 mol.L-1的溶液中:
①什么沉淀也不生成的最大pH应控制为 ;
②已知:pH=-4时,c(Fe 3+)小于1![]() mol.L-1,通过数据分析说明,控制溶液的pH是否可将Fe3+和Mg2+完全分 离 。
mol.L-1,通过数据分析说明,控制溶液的pH是否可将Fe3+和Mg2+完全分 离 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:

(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为21,则还原产物MFe2Ox中x= ,MFe2Ox中+2价铁与+3价铁的量之比为 。
(2)在酸性溶液中,Fe2O42―易转化为Fe2+: Fe2O42―+2e―+8H+→2Fe2++4H2O
有KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离于方程式并配平 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(15分)(1)、美国化学家富兰克林提出了酸碱的溶剂理论,对酸碱定义如下:在某溶剂的溶液中,凡能解离产生该溶剂阳离子的物质为酸;凡能解离产生该溶剂阴离子的物质为碱。这一理论不仅概括了水溶液中的酸碱概念,而且把酸碱概念引入非水溶剂,例如在液氨中2 NH3![]() NH4++NH2-铵盐(如 NH4Cl )表现为酸,氨基化物(如NaNH2)表现为碱。常见的无机非水溶剂有液态氨、硫酸、液态氟化氢、液态二氧化硫、三氟化溴等。已知液体SO2和纯水的导电性相近,实验测得两者的比导电值分别为 8×10-8Ω-1?cm-1和8×10-8Ω-1?cm-1。试用简要的文字和化学反应方程式给出解释:为什么在SO2的液体中,可用Cs2SO3去滴定SOCl2?
NH4++NH2-铵盐(如 NH4Cl )表现为酸,氨基化物(如NaNH2)表现为碱。常见的无机非水溶剂有液态氨、硫酸、液态氟化氢、液态二氧化硫、三氟化溴等。已知液体SO2和纯水的导电性相近,实验测得两者的比导电值分别为 8×10-8Ω-1?cm-1和8×10-8Ω-1?cm-1。试用简要的文字和化学反应方程式给出解释:为什么在SO2的液体中,可用Cs2SO3去滴定SOCl2?
(2)①已知盐酸是强酸,氢氟酸是弱酸。在室温下0.20mol/L氢氟酸水溶液中,氟离子的浓度是0.011mol/L,则氢氟酸的电离常数为 ; 取1.0L 0.20mol/L氢氟酸水溶液与1.0L 0.20mol/L盐酸混合,则溶液中氢离子、氟离子和氢氟酸的浓度各为 、 、 。
②某温度下,K(CH3COOH)=1.0×10-5,若醋酸的起始浓度为0.l0mol/L ,则平衡时溶液的pH是多少?(写出计算过程)
(3)①已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c (Br-)/c (Cl-) = 。②常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3g和2.1×10-1g,往CaSO4悬浊液中通入CO2可得到CaCO3,请解析CaSO4向CaCO3转化的原因。
查看答案和解析>>
科目:高中化学 来源:2011届山西省太原市高三模拟(二)(理综)化学部分 题型:填空题
已知A~N分别代表一种物质,它们之间的转化关系如图所示(部分反应的反应条件和生成物已略去)。A、B、C分别是由短周期元素组成的单质,A是金属,D是无色液体。F是一种离子化含物,其阴阳离子的个数比为1:3,且能与水反应得到两种碱。反应①是实验室检验某离予的方法,反应②是工业、生产N的重要反应。请回答下列问题:
(1)B元素在元素周期表中的位置是 ,F的电子式是 。
(2)写出反应①的离子方程式:
(3)Cu与足量的N的浓溶液反应得到的产物主要是M不是L,其原因是
(请用上图所示关系中反应的化学方程式回答)。
(4)选择性催化还原(SCR)是在有催化剂的条件下将M转变为无毒的物质,这是目前国外进行尾气治理遍采用的一种方法。亚铬酸铜(Adkin偿化剂)是极好的M催化还原的催化剂,是铜和铬的复合氧化物,成分不固定,如:aCuO·bCr2O3等,统称为亚铬酸铜。
CuNH4(OH)CrO4在295℃分解生成复合的氧化物(催化剂)、氮气及水,写出该反应的
化学方程式: 。
(5)已知一定温度(>100℃)下,反应②的平衡常数为1。将0.8 mol K和1.1mol B放入容积为1L的封闭容器中,发生反应②,一段时间后L的浓度为0.4 mol/L,此时反应v正 v逆(填“>”、“<”或“=”)。 当反应到达平衡后,保持温度不变,再加入一定物质的量的B,重新达到平衡,则L的平衡浓度 (填“增大”、“不变”或“减小”),B的转化率
_。(填“升高”、“不变”或“降低”),L的体积分数 (填“增大”、“不变”、“减小”或“无法确定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com