
| A. | 浓HCl | B. | 浓HN03 | C. | NaOH溶液 | D. | 稀HNO3 |
分析 常温下,浓HCl、NaOH溶液、稀HNO3均在常温下与铝持续发生氧化还原反应,Fe、Al遇浓硝酸和浓硫酸发生钝化,以此来解答.
解答 解:浓HCl、NaOH溶液、稀HNO3均在常温下与铝持续发生氧化还原反应,2Al+6HCl═2AlCl3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Al+4HNO3=Al(NO3)3+NO↑+2H2O,不会发生钝化,而常温下Al能被浓硝酸钝化,生成致密的氧化物阻止反应的进一步进行,
故选B.
点评 本题考查浓硝酸的性质及钝化,为基础性习题,把握发生钝化的金属为Fe、Al及酸为浓硝酸或浓硫酸为解答的关键,侧重性质的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
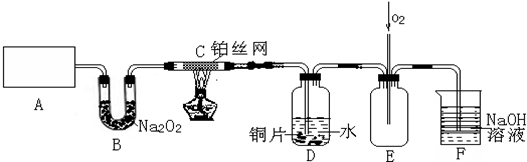
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合理摄入维生素C能增强对传染病的抵抗力,而且它还有解毒作用 | |
| B. | 维生素D属于典型的水溶性维生素 | |
| C. | 为减少新鲜蔬菜中的维生素C的流失,炒蔬菜的时间不能太长,炒熟即可 | |
| D. | 补充维生素D有利于人体钙的摄入 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H与D、16O与18O互为同位素,H216O、D216O、H218O、D218O互为同分异构体 | |
| B. | 金刚石、石墨均为碳的同素异形体,其化学性质与物理性质均不相同 | |
| C. |  石墨烯(结构如图所示)是由碳原子构成的单层片状结构的新材料,与石墨互为同位素 | |
| D. | 由于氢原子可以形成H-(如NaH),所以有人建议可将氢元素排在元素周期表的ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2不能在Cl2中燃烧 | B. | 在阳极得到H2 | ||
| C. | NaOH是弱碱 | D. | Cl2可用于制造漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com