
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Al3+ | 3.2 | 4.4 |
| Fe2+ | 6.3 | 8.4 |
| Ca2+ | 11.8 | \ |
| Mg2+ | 8.8 | 10.8 |
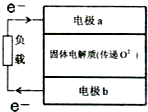
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
| ZnO | 100 | 75 | 50 | 25 | 0 | |
| 到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4mol | B. | 1.6mol | C. | 1.8mol | D. | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②④⑤ | C. | ①②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
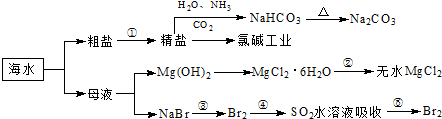
| A. | 制取NaHCO3的反应是利用其溶解度最小 | |
| B. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol -1 ) | 436 | 157 | 568 | 432 | 298[ |
| A. | H2(g)+F2(g)═2HF(g)△H=-25 kJ•mol -1 | |
| B. | 表中最稳定的共价键是H-F键 | |
| C. | H 2(g)→2H(g)△H=+436 kJ•mol -1 | |
| D. | 432 kJ•mol -1>E(H-Br)>298 kJ•mol -1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com