
·ÖĪö YµÄ×īĶā²ćµē×ÓŹĒĘäµē×Ó²ćŹżµÄČż±¶£¬ŌņYÖ»ÄÜ“¦ÓŚµŚ¶žÖÜĘŚ£¬×īĶā²ćµē×ÓŹżĪŖ6£¬ĪŖOŌŖĖŲ£»
XŗĶY²»ŌŚĶ¬Ņ»ÖÜĘŚ£¬ĖüĆĒŠĪ³ÉµÄ»ÆŗĻĪļ¼ČæÉŅŌÓėĖį·“Ó¦ÓÖæÉŅŌÓėĒæ¼ī·“Ó¦£¬øĆ»ÆŗĻĪļĪŖŃõ»ÆĀĮ£¬ŌņXĪŖAlŌŖĖŲ£»
YŗĶZŹōĶ¬×åŌŖĖŲ£¬ĖüĆĒÄÜŠĪ³ÉĮ½ÖÖ³£¼ū»ÆŗĻĪļ£¬ŌņZĪŖSŌŖĖŲ£»
WµÄŃōĄė×ÓYµÄŅõĄė×Ó¾ßÓŠĻąĶ¬µÄŗĖĶāµē×ÓÅŲ¼£¬ĒŅÄÜŠĪ³É×é³ÉĪŖWYµÄ»ÆŗĻĪļ£¬YĪŖŃõĄė×Ó£¬ŌņWÖ»ÄÜĪŖMgŌŖĖŲ£¬¾Ż“Ė½ųŠŠ½ā“š£®
½ā“š ½ā£ŗYµÄ×īĶā²ćµē×ÓŹĒĘäµē×Ó²ćŹżµÄČż±¶£¬ŌņYÖ»ÄÜ“¦ÓŚµŚ¶žÖÜĘŚ£¬×īĶā²ćµē×ÓŹżĪŖ6£¬ĪŖOŌŖĖŲ£»XŗĶY²»ŌŚĶ¬Ņ»ÖÜĘŚ£¬ĖüĆĒŠĪ³ÉµÄ»ÆŗĻĪļ¼ČæÉŅŌÓėĖį·“Ó¦ÓÖæÉŅŌÓėĒæ¼ī·“Ó¦£¬øĆ»ÆŗĻĪļĪŖŃõ»ÆĀĮ£¬ŌņXĪŖAlŌŖĖŲ£»YŗĶZŹōĶ¬×åŌŖĖŲ£¬ĖüĆĒÄÜŠĪ³ÉĮ½ÖÖ³£¼ū»ÆŗĻĪļ£¬ŌņZĪŖSŌŖĖŲ£»WµÄŃōĄė×ÓYµÄŅõĄė×Ó¾ßÓŠĻąĶ¬µÄŗĖĶāµē×ÓÅŲ¼£¬ĒŅÄÜŠĪ³É×é³ÉĪŖWYµÄ»ÆŗĻĪļ£¬YĪŖŃõĄė×Ó£¬ŌņWÖ»ÄÜĪŖMgŌŖĖŲ£¬
£Ø1£©øł¾Ż·ÖĪöæÉÖŖ£¬WŌŖĖŲŹĒMg£¬ZŌŖĖŲŹĒS£¬
¹Ź“š°øĪŖ£ŗMg£»S£»
£Ø2£©WĪŖMg”¢YĪŖO£¬Ōņ»ÆŗĻĪļWYµÄ»ÆѧŹ½ŹĒMgO£¬
¹Ź“š°øĪŖ£ŗMgO£»
£Ø3£©YŗĶZ·Ö±šĪŖO”¢S£¬¶žÕߊĪ³ÉĮ½ÖÖ³£¼ū»ÆŗĻĪļµÄ·Ö×ÓŹ½ŹĒSO2ŗĶSO3£¬
¹Ź“š°øĪŖ£ŗSO2£»SO3£»
£Ø4£©XÓėYŠĪ³ÉµÄ»ÆŗĻĪļĪŖŃõ»ÆĀĮ£¬Ńõ»ÆĀĮÓėNaOHČÜŅŗ·“Ӧɜ³ÉĘ«ĀĮĖįÄĘŗĶĖ®£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗAl2O3+2OH-=AlO2-+2H2O£¬
¹Ź“š°øĪŖ£ŗAl2O3+2OH-=AlO2-+2H2O£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪ»ÖĆ”¢½į¹¹ÓėŠŌÖŹ¹ŲĻµµÄÓ¦ÓĆ£¬ĢāÄæÄŃ¶Č²»“ó£¬ÕżČ·ĶʶĻŌŖĖŲĪŖ½ā“š¹Ų¼ü£¬×¢ŅāÕĘĪÕŌ×Ó½į¹¹ÓėŌŖĖŲÖÜĘŚ±ķ”¢ŌŖĖŲÖÜĘŚĀɵĹŲĻµ£¬Ć÷Č·ĀĮŌŖĖŲµ„ÖŹ¼°Ęä»ÆŗĻĪļŠŌÖŹ£®


 æģĄÖŹī¼ŁŹī¼ŁÄÜĮ¦×Ō²āÖŠĪ÷Źé¾ÖĻµĮŠ“š°ø
æģĄÖŹī¼ŁŹī¼ŁÄÜĮ¦×Ō²āÖŠĪ÷Źé¾ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
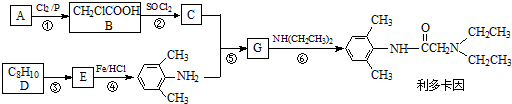
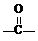 OH$\stackrel{SOCl_{2}}{”ś}$R
OH$\stackrel{SOCl_{2}}{”ś}$R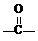 Cl
Cl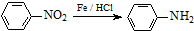
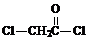 £¬¢ŽµÄ·“Ó¦ĄąŠĶŹĒČ”“ś·“Ó¦£®
£¬¢ŽµÄ·“Ó¦ĄąŠĶŹĒČ”“ś·“Ó¦£® £®
£®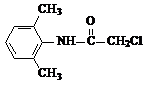 +2NaOH$\stackrel{”÷}{”ś}$
+2NaOH$\stackrel{”÷}{”ś}$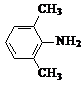 +HOCH2COONa+NaCl£®
+HOCH2COONa+NaCl£®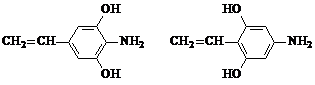 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
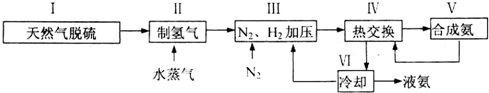
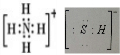 £¬Š“³öŌŁÉś·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ2NH4HS+O2$\frac{\underline{\;Ņ»¶ØĢõ¼ž\;}}{\;}$2NH3•H2O+2S£»NH3µÄ·ŠµćøßÓŚH2S£¬ŹĒŅņĪŖNH3·Ö×ÓÖ®¼ä“ęŌŚ×ÅŅ»ÖÖ½Š·Ö×Ó¼ä×÷ÓƵÄ×÷ÓĆĮ¦£®
£¬Š“³öŌŁÉś·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ2NH4HS+O2$\frac{\underline{\;Ņ»¶ØĢõ¼ž\;}}{\;}$2NH3•H2O+2S£»NH3µÄ·ŠµćøßÓŚH2S£¬ŹĒŅņĪŖNH3·Ö×ÓÖ®¼ä“ęŌŚ×ÅŅ»ÖÖ½Š·Ö×Ó¼ä×÷ÓƵÄ×÷ÓĆĮ¦£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 10£ŗ1 | B£® | 1£ŗ10 | C£® | 2£ŗ1 | D£® | 4£ŗ5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | ĪļÖŹ¼°ŌÓÖŹ | ¼ģŃé | ³żŌÓŹŌ¼Į»ņ·½·Ø |
| A | I2£ØCl2£© | ŹŖČóµÄµķ·Ū-KIŹŌÖ½ | NaIČÜŅŗ |
| B | NaHCO3ČÜŅŗ£ØNa2CO3£© | Ca£ØOH£©2ČÜŅŗ | ¹żĮæCO2 |
| C | CO2£ØHCl£© | AgNO3ČÜŅŗ£Øŗ¬Ļ”ĻõĖį£© | ±„ŗĶNa2CO3ČÜŅŗ |
| D | NO£ØNO2£© | ¹Ū²ģŃÕÉ«»ņŹŖČóµÄµķ·Ū-KIŹŌÖ½ | Ė® |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1£ŗ3 | B£® | 3£ŗ1 | C£® | 1£ŗ1 | D£® | 3£ŗ2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Al | B£® | Al£ØOH£©3 | C£® | AlCl3 | D£® | Al2O3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
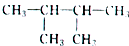 µÄĻµĶ³ĆüĆūĪŖ2£¬3-¶ž¼×»ł¶”Ķ飻
µÄĻµĶ³ĆüĆūĪŖ2£¬3-¶ž¼×»ł¶”Ķ飻²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 3 | B£® | 4 | C£® | 5 | D£® | 6 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com