
 ?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是| 化学式 | 电离常数(298 K) |
| H3BO3 | K=5.7×10-10 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| CH3COOH | K=1.75×10-5 |
科目:高中化学 来源:不详 题型:单选题

| A.HA是强酸 |
| B.该混合液pH=7 |
| C.图中x表示HA,Y表示OH-,Z表示H+ |
| D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 N2(g)+3H2(g),
N2(g)+3H2(g),| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强p 100 kPa | 5 | 5.6 | 6.4 | 6.8 | 7 | 7 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
| B.0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大 |
| C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变 |
D.若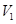 LpH=11的NaOH溶液与 LpH=11的NaOH溶液与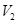 LpH=3的HA溶液混合后显中性,则 LpH=3的HA溶液混合后显中性,则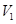 ≤ ≤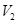 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
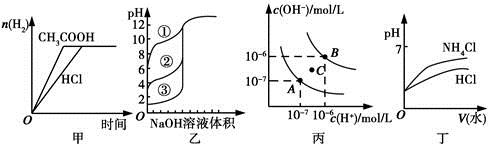
| A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化 |
| B.图乙表示用0.1000 mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由曲线可确定③的酸性最强 |
| C.图丙为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
| D.图丁表示将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数时,二者pH的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.0.2 mol·L-1氨水中,c(OH-)与c( )相等 )相等 |
| B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| C.0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
| D.pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中一定是c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
|
25℃时,下列关于0.1 mol·L-1的氨水和0.1 mol·L-1的醋酸溶液说法正确的是( )
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 )>c(SO
)>c(SO )>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
)>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com