



 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
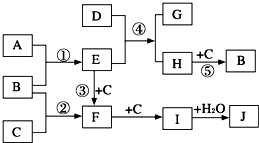 (2009?开封一模)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).
(2009?开封一模)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去).
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
如图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com