
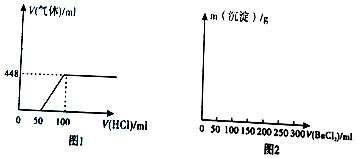
分析 (1)当加入100ml盐酸时,再继续添加盐酸生成气体体积不变,说明加100ml盐酸时碳酸钠已完全反应,据此分析;
(2)据此方程式Na2CO3+BaCl2=BaCO3↓+2NaCl进行分析.
解答 解:(1)加入100ml盐酸时,再继续添加盐酸生成气体体积不变,说明加100ml盐酸时碳酸钠已完全反应,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
1 22.4
n 0.448
$\frac{1}{n}=\frac{22.4}{0.448}$,n=0.02mol,c=$\frac{0.02mol}{0.1L}$=0.2mol/L
故答案为:0.2mol/L
(2)n(Na2CO3)=0.2mol/L×0.1ml=0.02mol
Na2CO3+BaCl2=BaCO3↓+2NaCl
1 1 197
0.02 0.02 3.94
V(BaCl2)=$\frac{0.02mol}{0.2mol/L}$=100ml
故当Na2CO3完全反应时,消耗BaCl2的体积为100ml,最终生成生成沉淀的质量为3.94g,故图为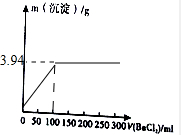
故答案为:3.94;
点评 本题是一题综合性的题目,将溶液,化学反应和图象融合在一起,由一定的难度,学生会分析图是本题解题的关键.


科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol•L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内O2的平均生成速率为7.4×l0-4mol•L-1•s-1 | |
| B. | T1温度下该反应达到平衡时,平衡混合物中NO2的体积分数为50% | |
| C. | 达到平衡后,其他条件不变,将容器体积压缩到原来的1/2,则c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(Cl2)=0.0016 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则该反应的△H<0 | |
| C. | 温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)<v(逆) | |
| D. | 温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
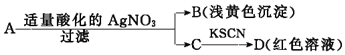
| A. | D溶液中存在Fe(SCN)3 | B. | 滤液C中有Fe3+ | ||
| C. | B为AgBr | D. | A一定是FeBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

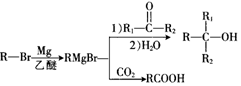
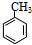 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$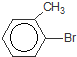 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应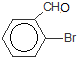
 ,H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为
,H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为
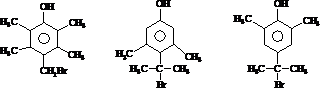
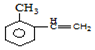 )的路线流程图(其他试剂任选)
)的路线流程图(其他试剂任选)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
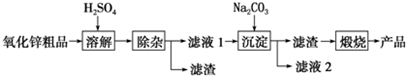
| 沉淀物 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Fe(OH)2 |
| pH | 3.2 | 6.7 | 8.0 | 9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com