
| A. | 加入硝酸银溶液有白色沉淀生成,证明含有氯离子 | |
| B. | 加入氯化钡溶液有白色沉淀生成,继续加过量的稀盐酸,沉淀不消失,证明溶液中含有硫酸根离子 | |
| C. | 加浓氢氧化钠溶液后加热,产生使湿润红色石蕊试纸变蓝的气体,证明含有铵根离子 | |
| D. | 加入盐酸,放出能使澄清石灰水变浑浊的无色无味气体,证明含有碳酸根离子 |
分析 A、根据加入硝酸银生成的可能是AgCl沉淀,也可能是别的白色沉淀判断;
B、根据向某溶液中加入硝酸酸化的氯化钡溶液,可能生成AgCl、BaSO4等沉淀判断;
C、根据氢氧化钠和铵盐反应生成氨气,氨气和水反应生成氨水,氨水是一种碱能使湿润的红色石蕊试纸变蓝分析判断;
D、碳酸根、碳酸氢根等离子都可以和氢离子之间反应产生气体.
解答 解:A、加入硝酸银生成的可能是AgCl沉淀,也可能是别的白色沉淀如硫酸银,故A不正确;
B、向某溶液中加入硝酸酸化的氯化钡溶液,可能生成AgCl、BaSO4等沉淀,不能证明溶液中含有硫酸根离子,故B不正确;
C、向某溶液中加入氢氧化钠,产生能使湿润的红色石蕊试纸变蓝的气体即为氨气,则证明该溶液含有铵根离子,故C正确;
D、加入盐酸,放出能使澄清石灰水变浑浊的无色无味气体,证明含有碳酸根离子或是碳酸氢根离子中的至少一种,故D不正确.
故选C.
点评 本题考查离子鉴别题目,做题时注意从题目中找出反应的典型现象,根据物质的性质进行推断.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 胶体能发生电泳现象 | B. | 胶体能产生丁达尔现象 | ||
| C. | 胶体粒子直径在1~100nm之间 | D. | 胶体在一定条件下能聚沉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
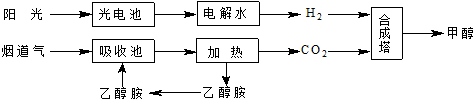
| 反应时间/min | 3 | 5 | 7 | 10 | 13 |
| c(CO2)/mol•L-1 | 0.50 | 0.37 | 0.30 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
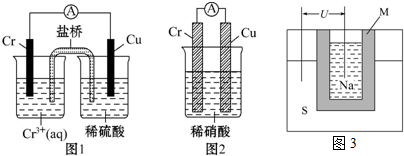
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 澄清的石灰水与稀盐酸反应 Ca (OH)2+2H+═Ca2++2H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液、CuO、HClO、Cu | |
| B. | 普通玻璃、H2O、FeCl3、葡萄糖 | |
| C. | 水银、Na2O、BaSO4、SO3 | |
| D. | KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4 | B. | CH4、C3H6 | C. | C2H4、C3H6 | D. | C2H2、C3H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com