
【题目】在一定温度下、一定体积条件下,能说明下列反应达到平衡状态的是
A.反应2SO2(g)+O2(g)![]() 2SO3(g) 容器内的密度不随时间变化
2SO3(g) 容器内的密度不随时间变化
B.反应A2(g)+B2(g)![]() 2AB(g)容器内A2的消耗速率与AB消耗速率相等
2AB(g)容器内A2的消耗速率与AB消耗速率相等
C.反应N2+3H2![]() 2NH3容器内气体平均相对分子质量不随时间变化
2NH3容器内气体平均相对分子质量不随时间变化
D.反应4A(s)+3B(g)![]() 2C(g)+D(g)容器内气体总压强不随时间变化
2C(g)+D(g)容器内气体总压强不随时间变化
【答案】C
【解析】
试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A.密度=混合气的质量÷容器容积,在反应过程中质量和容积始终是不变的,不能说明反应达到平衡状态;B.A2的消耗速率与AB消耗速率相等,不能说明反应达到平衡状态,故B错误;C.混合气的平均相对分子质量=混合气体的质量÷混合气体的总的物质的量,C中质量不变,但物质的量是变化的,当容器内气体平均相对分子质量不随时间变化时,说明反应达到平衡状态,故C正确;D.反应前后气体体积是不变的,所以压强也是始终不变的,不能说明反应达到平衡状态,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】【2016江苏卷】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1 Na2SO3溶液的pH约为10;0.1mol·L–1 NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 SO32–的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质中,物质之间不可能实现如图![]() 所示转化的是( )
所示转化的是( )
选项 | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | S(s) | SO2 | SO3 | O2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A.沸点:CH4>NH3>H2O
B.得电子能力:C>N>O
C.酸性:H2SO4>HClO4>H3PO4
D.碱性:NaOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在空气中燃烧可以生成SO2,SO2在催化剂作用下可以被氧化为SO3,其热化学方程式可表示为:S(g) +O2(g)═SO2(g) △H=-297kJ/mol,SO2(g) + 1/2O2(g)![]() SO3(g);△H =-98.3 KJ/mol。下图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量。
SO3(g);△H =-98.3 KJ/mol。下图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量。
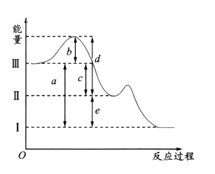
(1)Ⅰ→Ⅱ的反应是________(填“吸热”,“放热”)反应。
(2)c为____________KJ。
(3)图示中b的大小对Ⅲ→Ⅱ反应的△H的影响是______。
A.△H随着b的增大而增大
B.△H随着b的增大而减小
C.△H随着b的减小而增大
D.△H不随b的变化而变化
(4)上图中的d+e-b=________________KJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1) FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________。
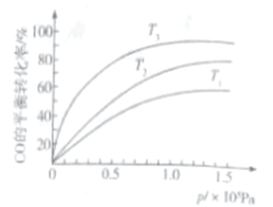
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入到压强为P0的恒压密闭容器中,测得不同时间CO的体积分数![]() (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当______不再发生变化时(写出一条即可),则表明CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____(已知:气体分压=气体总压×体积分数)。
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
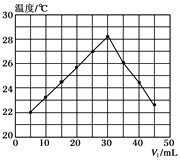
A. 做该实验时环境温度为22℃
B. NaOH溶液的浓度约为1.5mol/L
C. 该实验中需要使用环形玻璃搅拌棒在水平方向轻轻转动搅拌
D. 该实验可用相同物质的量的氢氧化钠固体投入盐酸中测定中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入2mol/L的盐酸,当加入盐酸的体积为45mL时产生CO2的体积为896 mL(标准状况),之后再加入盐酸不再产生CO2。
(1)当加入40 mL盐酸时,产生二氧化碳的体积为_________mL;(标准状况)
(2)计算原混合物中Na2CO3的质量分数为____________;
(3)请在右图中绘制出加入盐酸体积与产生CO2体积的关系曲线。(要在纵坐标上标明标准状况下CO2体积的数值)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别代表NaCl、金刚石、干冰、石墨结构的一部分。下列说法正确的是( )
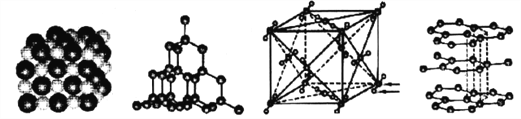
A. NaCl晶体只有在熔融状态下离子键被完全破坏,才能形成自由移动的离子
B. 金刚石中存在的化学键只有共价键,不能导电
C. 干冰中的化学键只需吸收很少的热量就可以破坏,所以干冰容易升华
D. 石墨中碳原子的最外层电子都参与了共价键的形成,故熔点很高、硬度很大。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com