
| A. | 肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32- | |
| B. | 肯定存在的离子是Na+、K+、SO32-、Br- | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤④改用BaCl2溶液和盐酸的混合溶液,则对溶液中离子的判断无影响 |
分析 ①pH试纸检验,溶液的pH>7,证明溶液显示碱性,②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,则一定不存在硫酸根离子,③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,则为溴水的颜色,一定不含有碳酸根离子,④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,可以证明亚硫酸根离子的存在,⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀.
解答 解:某无色溶液中一定不存在:Fe3+、Cu2+,①pH试纸检验,溶液的pH>7,证明溶液显示碱性,一定含有钠离子或是钾离子中的至少一种,②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,则一定不存在硫酸根离子,③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,则一定不含CO32-,可能含有SO32-,亚硫酸根能被溴水氧化为硫酸根离子,再加入CCl4振荡,静置后CCl4层呈橙色,则为溴水的颜色,一定含有溴离子,④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,可以证明硫酸根离子的存在,即是亚硫酸根被氧化生成的硫酸根离子,一定不存在铵根离子,因为二者会双水解而不共存,⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀,但是在③中加入的氯水中含有氯离子,不能确定是否存在待测离子中的氯离子.
A、肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-,故A正确;
B、肯定存在的离子是SO32-、Br-,还有Na+、K+中的至少一种,故B错误;
C、在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生,即为氯化银沉淀,但是在③中加入的氯水中含有氯离子,不能确定是否存在待测离子中的氯离子,故C正确;
D、若步骤④改用BaCl2溶液和盐酸的混合溶液,则硫酸根离子会和BaCl2溶液反应生成难溶物质硫酸钡,但是硫酸根一定是亚硫酸根离子被氧化来的,此时对溶液中离子的判断无影响,故D正确.
故选B.
点评 本题考查离子的检验,物质的检验是化学的重难点,也是考试的热点之一,了解物质或离子的化学性质是本题解题的关键,综合性较强,难度大.


科目:高中化学 来源: 题型:解答题
 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | B. | 金刚石比石墨稳定 | ||
| C. | 石墨转化为金刚石是一个物理变化 | D. | 石墨和金刚石是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
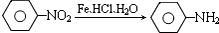 (苯胺、弱碱性、易被氧化)
(苯胺、弱碱性、易被氧化)
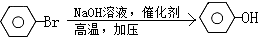


 D:
D: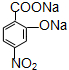 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 | |
| D. | 完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
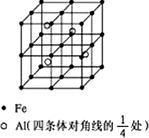 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
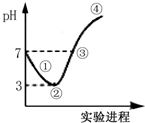 常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )
常温下,将Cl2缓缓通入水中至饱和,然后向所得饱和溶液中滴加0.1mol•L-1 NaOH溶液,整个过程中pH的变化如图所示.下列有关叙述正确的是( )| A. | 从反应开始至②点,发生反应的离子方程式为:Cl2+H2O═ClO-+2H++Cl- | |
| B. | ③处表示氯气和NaOH溶液恰好完全反应 | |
| C. | ②点所表示的溶液中所存在的具有氧化性的含氯元素的微粒主要有:Cl2、HClO、ClO- | |
| D. | 从反应开始至②点可用pH试纸测定溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m>n | B. | m<n | C. | m=n | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com