
| A. | 与少量Al2(SO4)3溶液反应的离子方程式为Al3++40H-═AlO2-+2H2O | |
| B. | 该溶液中滴入酚酞变红,是因NH3•H2O?NH4++0H- | |
| C. | 该溶液中Na+、NH4+、NO3-、Mg2+可大量共存 | |
| D. | 与少量CuSO4溶液反应的离子方程式:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
分析 A.氨水为弱碱,反应生成的是氢氧化铝沉淀,且一水合氨不能拆开;
B.一水合氨在溶液中部分电离出氢氧根离子,所以氨水呈碱性;
C.镁离子与氢氧根离子反应生成氢氧化镁沉淀;
D.硫酸铜少量,氢氧化铜溶解,反应生成的是[Cu(NH3)4]2+.
解答 解:A.氨水为弱碱,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.该溶液中滴入酚酞变红,说明溶液呈碱性,一水合氨的电离方程式为:NH3•H2O?NH4++0H-,故B正确;
C.Mg2+与氨水中氢氧根离子反应生成氢氧化镁沉淀,在溶液中不能大量共存,故C错误;
D.氨水少量时的反应方程式为:CuSO4+2NH3•H2O=Cu(OH)2↓+(NH4)2SO4,氨水过量时氢氧化铜沉淀溶解:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,所以最终得到的是[Cu(NH3)4]2+,故D错误;
故选B.
点评 本题考查离子共存的正误判断、离子方程式的书写方法,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,熟练掌握离子方程式的书写原则;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力


科目:高中化学 来源: 题型:解答题
| 牙膏品牌 | 两面针儿童牙膏 | 中华透明牙膏 | 珍珠防臭牙膏 |
| 摩擦剂 | 氢氧化铝 | 二氧化硅 | 碳酸钙 |
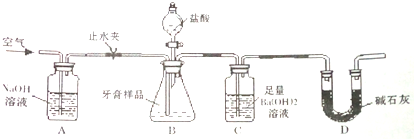
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | C2H4通入溴水中 | 溶液褪色 | C2H4跟Br2发生加成反应 |
| B | 向溶液X中滴入NaHCO3溶液 | 产生无色气体 | X中的溶质一定是酸 |
| C | Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加 0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生, 硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤⑥ | C. | ②④⑥ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇 | B. | 乙醇 | C. | 乙醛 | D. | 丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ②③⑤⑥ | C. | ②⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
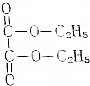 草酸二乙酯为无色油状液体,有芳香气味,主要用于医药工业中,是硫唑嘌呤、周效磺胺、羧苯脂青霉索等药物的中间体,已知它的结构如图所示:提示:
草酸二乙酯为无色油状液体,有芳香气味,主要用于医药工业中,是硫唑嘌呤、周效磺胺、羧苯脂青霉索等药物的中间体,已知它的结构如图所示:提示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com