
| A. | 常温常压下,60gCH3COOH中含共用电子对数为7NA | |
| B. | 56g聚乙烯含有的碳原子数为4NA | |
| C. | 2molSO2和1molO2在密闭容器中充分反应后,容器内物质分子数等于2NA | |
| D. | 2L0.5mol/L乙酸溶液中H原子数为0.1NA |
分析 A.1个乙酸分子含有3个C-H,1个O-H,1个C-O,1个C=O,共用8对电子;
B.聚乙烯的最简式为CH2,28g聚乙烯中含有最简式4mol,含有4mol碳原子;
C.二氧化硫与氧气反应生成三氧化硫为可逆反应,不能进行到底;
D.乙酸溶液中水分子、乙酸分子都含有氢原子.
解答 解:A.常温常压下,60gCH3COOH物质的量为1mol,含共用电子对数为8NA,故A错误;
B.56g聚乙烯含有的碳原子数为4NA,故B正确;
C.二氧化硫与氧气反应生成三氧化硫为可逆反应,不能进行到底,所以2molSO2和1molO2在密闭容器中充分反应后,容器内物质分子数大于2NA,故C错误;
D.乙酸溶液中水分子、乙酸分子都含有氢原子,所以2L0.5mol/L乙酸溶液中H原子数远远大于0.1NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,注意可逆反应不能进行到底的特点,注意乙酸分子、聚乙烯分子的结构.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
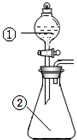 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硫酸 | 用砂纸打磨过的铝条 | 无明显现象 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 稀硝酸 | 铜片 | 立即产生大量红棕色气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体中含有阴离子的数目为2NA | |
| B. | 3.6g水含有极性键的数目为0.4NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
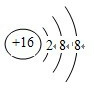 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
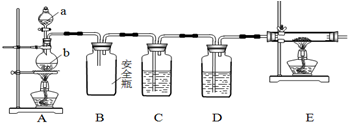
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂的使用,可以降低反应的温度,起到节能的效果 | |
| B. | 中科院国家纳米科学中心宣布,该中心科研人员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据.水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 石墨烯是一种由碳原子构成的单层片状结构的新材料,因此具有巨大的表面积,通过穿透式电子显微镜可用于直接观测单原子的吸附和释放过程 | |
| D. | 推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2、PM2.5,使天空重现“APEC蓝” |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
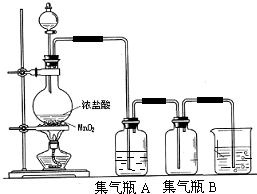 实验室中所用少量氯气是用下列方法制取:
实验室中所用少量氯气是用下列方法制取:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com