
【题目】实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
![]()
![]()
![]()
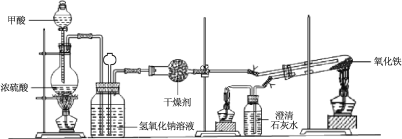
① 按上图连接好装置,检查装置气密性。
② 称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③ 在完成某项操作后,点燃另外两处酒精灯。
④ 30 min后熄灭酒精灯,关闭弹簧夹。
⑤ 待产物冷却至室温后,收集产物。
⑥ 采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物。
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为 ,该反应的化学方程式 。
(2)实验步骤③某项操作是指 。
(3)实验步骤④熄灭酒精灯的顺序为______________。(填I,II,III)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃。
II.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。试分析酒精灯加热条件下生成Fe的原因是 。
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%。利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
加热方式 | 产物元素组成 | 各元素的质量分数%[§科§网] | |
Fe | O | ||
酒精灯 | Fe和O | 74.50 | 25.50 |
带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
酒精喷灯 | Fe | 100.00 | 0.00 |
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有_______种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为_____。(要求保留整数)
【答案】(1)分液漏斗(2分) HCOOH![]() CO↑ + H2O(2分) (2)检验CO纯度(2分)
CO↑ + H2O(2分) (2)检验CO纯度(2分)
(3)III,I,II (答III,II, I也给分)(2分)
(4)长时间集中加热使局部温度达到还原生成铁所需要的温度(2分)(其它正确答案参照给分)
(5)9种(2分) (6)12:1(2分)
【解析】
试题分析:(1)在浓硫酸加热条件下,HCOOH分解可得CO,根据质量守恒可知另一个产物为水,反应的化学方程式为:HCOOH![]() CO↑+H2O,盛放甲酸的仪器名称为分液漏斗。
CO↑+H2O,盛放甲酸的仪器名称为分液漏斗。
(2)CO是可燃性气体,因此应先检验CO纯度后点燃另外两处酒精灯,先检验CO纯度目的看试管内的空气是否排净,防止爆炸。
(3)实验结束后要等试管冷却后才停止通一氧化碳,故先熄灭Ⅲ处酒精灯,是为了防止生成热的铁被空气中的氧气氧化;应最后熄灭Ⅰ处酒精灯,目的是防止多余的一氧化碳进入空气中污染环境。所以实验步骤④熄灭酒精灯的顺序为 Ⅲ、Ⅱ、Ⅰ。
(4)加网罩酒精灯平均温度为700℃,当反应温度高于710℃,Fe能稳定存在,温度差比较小,长时间集中加热可使局部温度达到生成还原铁所需要的温度。
(5)由数据可知,Fe、FeO、Fe2O3、Fe3O4中Fe元素的百分含量分别为100﹪、77.8%、70%、72.4%,酒精灯加热所得产物中Fe元素的百分含量为74.50%,混合物中至少有一个Fe元素含量大于74.50%,至少有一个Fe元素含量小于74.50%,故混合物中一定有Fe和FeO中的至少一种,也一定有Fe2O3和Fe3O4中的一种,这样就会出现,两种混合的有4种:Fe、Fe2O3,Fe、Fe3O4,FeO、Fe2O3,FeO、Fe3O4,三种混合的有4种:Fe、Fe2O3和Fe3O4,FeO、Fe2O3和Fe3O4,Fe2O3、Fe和FeO,Fe3O4、Fe和FeO ,四种混合的有1种:Fe、FeO、Fe2O3和Fe3O4,共9种。
(6)根据酒精灯加热得到的产物为Fe3O4和Fe,且铁元素的百分含量为74.50%,设Fe3O4的质量为x,Fe的质量为y,则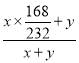 =74.50%,解得:
=74.50%,解得:![]() ≈12:1。
≈12:1。


科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成。现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g。回答下列问题:
(1)3gA中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小。请回答:
(1)A、B、C、D的第一电离能由小到大的顺序是__________(用元素符号填空)
(2)化合物BD3的分子构型为__________,B的原子轨道杂化类型为__________。B元素氢化物的沸点低于其同族上周期元素的氢化物的原因是__________。
(3)己知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物.则F的基态原子价电子排布式为__________,CN-与__________(一种分子)互为等电子体.消除CN-剧毒性的方法之一是加入浓的双氧水,可将其转化为可溶性碳酸盐及氨气,写出该反应的离子方程式:__________。
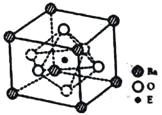
(4)①E基态原子的价电子排布为__________,②EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为__________。
③已知该晶体的摩尔质量为M(g/mol),其中E4+的氧配位数为__________。若该晶胞边长为anm,可计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示是一个制取氯气并以氯气为原料进行特定反应的装置,多余的氯气可以贮存在b瓶中,其中各试剂瓶中所装试剂为:B(氢硫酸)、C(碘化钾淀粉溶液)、D(水)、F(紫色石蕊试液)。
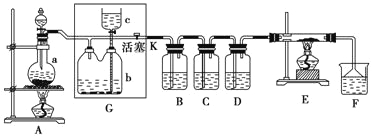
(1)若A中烧瓶中的固体为MnO2,液体为浓盐酸,则其发生反应的化学方程式为______。
(2)如何检查装置G的气密性:______(写出操作方法和现象)。
(3)G中b瓶内宜加入的液体是______;实验开始后B中的现象是______,C中的现象是______,F的现象是______。
(4)E装置中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BPA的结构简式如右下图所示,常用来生产防碎塑料聚碳酸酯。

(1)该物质的分子式为___________,含氧官能团的名称是_________,属于____类。
(2)该物质最多_____个碳原子共面。
(3)充分燃烧0.1mol该有机物,消耗的O2在标准状况下的体积为_________。
(4)下列关于BPA的叙述中,不正确的是_______。
A.可以发生还原反应
B.遇FeCl3溶液紫色
C.1mol该有机物最多可与2molH2反应
D.可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
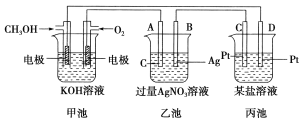
【题目】如图所示是一个电化学装置的示意图。
请回答下列问题:
(1)图中甲池是________(填“原电池”、“电解池”或“电镀池”)。
(2)A(石墨)电极的名称是________(填“正极”、“负极”、“阴极”或“阳极”)。
(3)写出通入CH3OH的电极的电极反应式:_________________________________。
(4)乙池中反应的化学方程式为______________________________________。
(5)当乙池中B(Ag)极质量增加5.4 g时,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出1.6 g某金属,则丙池中的某盐溶液可能是________(填字母)。
A. MgSO4 B.CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如下图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | A中的物质 | B中的物质 | C中收集的气体 | D中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列是中学化学中熟悉的物质,请用序号完成下列问题
①O2 ②Na2O2 ③NH4Cl ④HCl ⑤NaOH ⑥CaCl2 ⑦氦气
(1)这些物质中,只含共价键的是 。只含离子键的是 。既含共价键又含离子键的是 。
(2)属于离子化合物的是 。
II.(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。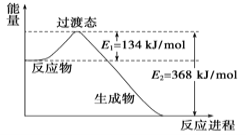
(2)已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要_____________(填“放出”或“吸收”)_____________kJ的热量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为_____________,G的原子结构示意图是__________________________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为_________,所含化学键类型为___________,向甲中滴加足量水时发生反应的化学方程式是____________________________。
(3)E、F、G三种元素形成的简单离子,半径由大到小的顺序是__________。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,则a极是该电池的________极,正极的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com