


科目:高中化学 来源: 题型:
| A、Na+、Cl-、CO32-、SO32- |
| B、K+、ClO-、Cl-、SO42- |
| C、Ca2+、Mg2+、NO3-、HCO3- |
| D、NH4+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在密闭容器中加入1mol N2和3mol H2,充分反应生成NH3分子数为2NA |
| B、标准状况下,22.4L的CCl4分子中含有共价键数为4NA |
| C、常温常压下,1mol NaHSO4晶体中含有2NA个离子 |
| D、电解饱和食盐水,当阴极产生2.24L H2时,转移的电子数一定为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2016年奥运会将在里约热内卢举行,如图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3:4,电子数之比为3:2.
2016年奥运会将在里约热内卢举行,如图类似奥运五环,表示A、B、C、D、E五种化合物,环交叉部分代表两种化合物含有一种相同元素,且交叉部分所代表的元素各不相同,五种化合物由五种短周期元素组成,且每种化合物仅由两种元素组成.A是可燃冰的主要成分;B、E分子中所含电子总数均与硅烷(SiH4)分子的电子数相等,B不稳定,具有较强氧化性,能发生自身氧化还原反应,E的相对分子质量为32,具有还原性,且常用作航天器的燃料;D是新型无机非金属材料,它所含两种元素的原子个数之比为3:4,电子数之比为3:2.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | 原子最外层有3个未成对电子,次外层只有一对成对电子 |
| Z | Z存在质量数为27,中子数为14的核素 |
| W | +3价离子3d能级为半充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10-9 | 6.8×10-6 | 5.5×10-6 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
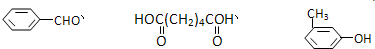
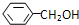 互为同分异构体的是
互为同分异构体的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将FeCl3溶液加热至沸腾,溶液由黄色变为红褐色 |
B、 滴定达终点时,如图滴定管的正确读数为23.65 mL |
| C、向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 |
| D、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com