
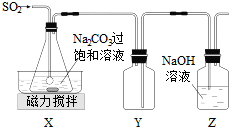
分析 (1)向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2;
(2)二氧化硫易溶于氢氧化钠溶液,Y为安全瓶,可防止倒吸;
(3)①组成减压抽滤装置的主要仪器是布氏漏斗、吸滤瓶和抽气泵;
②用饱和SO2水溶液洗涤,可降低溶质的溶解度;
(4)Na2S2O5易分解生成a2SO3,且Na2SO3易被氧化.
解答 解:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,多余的二氧化硫可用氢氧化钠溶液吸收,因二氧化硫易溶于氢氧化钠溶液,Y为安全瓶,可防止倒吸,
(1)向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,反应的离子方程式为2SO2+CO32-+H2O=2HSO3-+CO2,
故答案为:2SO2+CO32-+H2O=2HSO3-+CO2;
(2)二氧化硫易溶于氢氧化钠溶液,Y为安全瓶,可防止倒吸,故答案为:防止倒吸;
(3)①组成减压抽滤装置的主要仪器是布氏漏斗、吸滤瓶和抽气泵,故答案为:吸滤瓶;
②由反应2NaHSO3═Na2S2O5+H2O可知,增大HSO3-的浓度,有利于生成Na2S2O5,用饱和SO2水溶液洗涤,可降低Na2S2O5的溶解度,减少Na2S2O5的溶解,
故答案为:减少Na2S2O5在水中的溶解;
(4)Na2S2O5易分解生成Na2SO3,且Na2SO3易被氧化,可知验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,
故答案为:在制备过程中Na2S2O5易分解生成Na2SO3,且Na2SO3易被氧化生成Na2SO4.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,解答本题注意把握物质的性质以及题给信息,要具有扎实的实验基础知识,难度不大.


科目:高中化学 来源: 题型:推断题
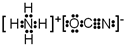 或
或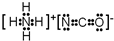 .
. .A、B元素形成的最简单的化合物不能与E2+形成配合物的原因是CH4不能提供孤对电子.
.A、B元素形成的最简单的化合物不能与E2+形成配合物的原因是CH4不能提供孤对电子.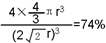 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,78g Na2O2的分子数为NA | |
| B. | 标准状况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标准状况下,22.4mL H2O中含水分子的个数约为1.24NA | |
| D. | 17g NH3溶于水后溶质NH3的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏时把温度计插入液面下 | |
| B. | 向银氨溶液中加入几滴乙醛后用酒精灯加热至沸腾制银镜 | |
| C. | 检验卤代烷中的卤素元素可先将卤代烷与NaOH溶液混合加热,然后加入AgNO3溶液,根据生成沉淀的颜色初步确定卤素 | |
| D. | 用乙醇、醋酸和18mol/L的硫酸混合加热制乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应放热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
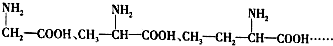
 ,B
,B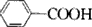 ,CCH2(NH2)COOH.
,CCH2(NH2)COOH.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | Cl2 (g) | HCl(g) | 饱和NaCl溶液、浓硫酸 | 洗气 |
| B | Na2CO3(aq) | NaHCO3(aq) | 过量NaOH溶液 | 洗液 |
| C | 铁粉(s) | 铝粉(s) | 过量NaOH溶液 | 过滤 |
| D | FeCl3(aq) | AlCl3(aq) | 过量氨水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7 | |
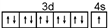
| B. | N原子的轨道表示式: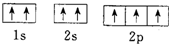 违反了泡利不相容原理 违反了泡利不相容原理 | |
| C. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 | |
| D. | 电子排布式(23V)1s22s22p63s23p63d34s2违反了洪特规则 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
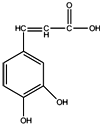
| A. | 1mol该有机物分别与足量的Na、NaOH、Na2CO3反应,消耗它们的物质的量之比为3:3:1 | |
| B. | 所有碳原子可能共平面 | |
| C. | 与溴水既能发生取代反应又能发生加成反应 | |
| D. | 能与新制的Cu(OH)2反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com