
分析 (1)①根据n=$\frac{V}{Vm}$计算该气体的体积,再根据M=$\frac{m}{n}$计算其摩尔质量;
②计算MCl2的物质的量,根据M=$\frac{m}{n}$计算其摩尔质量,进而计算M的相对原子质量;
③根据n=$\frac{m}{M}$计算碳酸钠晶体的物质的量,溶液中碳酸钠的物质的量等于碳酸钠晶体的物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度;
④根据V=$\frac{m}{M}$Vm知,相同质量、相同气体摩尔体积时,气体体积与摩尔质量成反比;
(2)①根据各仪器的作用选取仪器;
②m(KMnO4)=cVM,据此计算;
③根据c=$\frac{n}{V}$知,如果n偏小或V偏大都导致配制溶液浓度偏小.
解答 解:(1)①在标准状况下,测得1.92g某气体的体积为672mL,其物质的量=$\frac{0.672L}{22.4L/mol}$=0.03mol,故该气体的摩尔质量为$\frac{1.92g}{0.03mol}$=64g/mol,故答案为:64g/mol;
②MCl2的物质的量为$\frac{0.2mol}{2}$=0.1mol,故其摩尔质量为$\frac{9.5g}{0.1mol}$=95g/mol,则M的相对原子质量为95-35.5×2=24,
故答案为:24;
③碳酸钠晶体的物质的量=$\frac{71.5g}{286g/mol}$=0.25mol,溶液中碳酸钠的物质的量等于碳酸钠晶体的物质的量,溶液物质的量浓度=$\frac{0.25mol}{0.5L}$=0.5mol/L,故答案为:0.5mol/L;
④根据V=$\frac{m}{M}$Vm知,相同质量、相同气体摩尔体积时,气体体积与摩尔质量成反比,所以体积最大的是H2,体积是$\frac{10g}{2g/mol}$×22.4L/mol=112L,故答案为:112L;
(2)①还需要配制溶液的100mL容量瓶、用于定容的胶头滴管,故答案为:100mL容量瓶;胶头滴管;
②m(KMnO4)=CVM=0.5mol/L×0.1L×158g/mol=7.9g,故答案为:7.9;
③根据c=$\frac{n}{V}$知,如果n偏小或V偏大都导致配制溶液浓度偏小,
A.颠倒摇匀后发现凹液面低于刻度线又加水补上,导致溶液体积偏大,配制溶液浓度偏小,故正确;
B.加水定容时俯视刻度线,导致溶液体积偏小,配制溶液浓度偏大,故错误;
C.容量瓶内壁附有水珠而未干燥处理,溶液体积和溶质物质的量都不变,则配制溶液浓度不变,故错误;
D.在溶解过程中有少量液体溅出烧杯外,溶质的物质的量偏小,配制溶液浓度偏小,故正确;
故选AD.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用,有利于基础知识的巩固.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 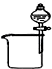 分离碘和酒精 | B. | 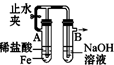 较长时间观察Fe (OH)2白色沉淀 | ||
| C. | 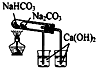 验证NaHCO3和Na2CO3的热稳定性 | D. | 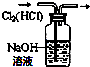 除去Cl2中HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl不导电,因此HCl是非电解质 | |
| B. | Na2O熔融态时能导电,所以Na2O是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | CO2水溶液能导电,所以CO2是电解质. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 放电时,锂为负极,发生还原反应 | |
| B. | 充电时阳极反应式为:8Li2S-16e-═S8+16Li+ | |
| C. | 电解质可采用导电有机电解质 | |
| D. | 锂硫电池的理论电压为2.0V,则单位质量的单质硫的比能量为3.35 kW•h/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 1.33 mol | C. | 2 mol | D. | 3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com