
| A. | H:H | B. | 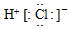 | C. | 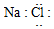 | D. | 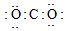 |
分析 A、氢气中两个氢原子通过共用1对电子达到稳定结构;
B、氢原子最外层1个电子,氯原子最外层7个电子,HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物;
C、氯化钠是离子化合物,根据离子化合物的电子式书写方法来写;
D、二氧化碳中C原子和O原子间为碳氧双键.
解答 解:A、氢气中两个氢原子通过共用1对电子达到稳定结构,氢气的电子式为:H:H,故A正确;
B、HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为 ,故B错误;
,故B错误;
C、氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ,故C错误;
,故C错误;
D、CO2是共价化合物,碳原子有四个电子分别和氧原子形成两对共用电子对,电子式为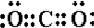 ,故D错误.
,故D错误.
故选A.
点评 本题考查了电子式的书写,题目难度中等,试题涉及的题量较大,注意掌握电子式的概念及正确的书写方法,明确原子、阴阳离子的电子式的区别.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙炔 | B. | 聚乙烯 | C. | 聚苯乙烯 | D. | 聚丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CO2的质量是44g | |
| B. | 17 g NH3的体积是22.4 L | |
| C. | 100 mL 1 mol/L NaOH溶液中含有1 mol OH- | |
| D. | 标准状况下,11.2 L O2中含有6.02×1023个氧分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
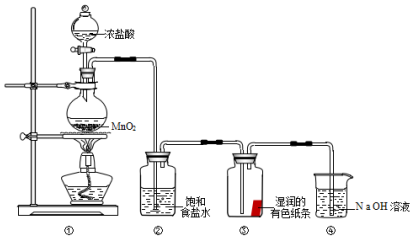
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
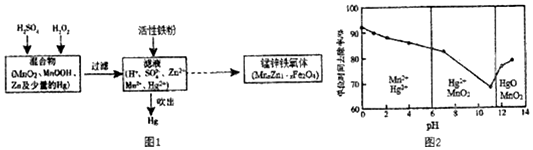
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
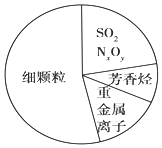
| A. | 雾霾天气不能产生丁达尔现象 | |
| B. | 重金属离子对人体的危害主要是造成蛋白质的变性 | |
| C. | SO2和NxOy都属于酸性氧化物 | |
| D. | “APEC蓝”是2014年新的网络词汇,形容2014年APEC会议期间北京蓝蓝的天空,说明京津冀实施道路限行和污染企业停工等措施,可杜绝雾霾的发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com