
【题目】我国矿石种类很多,如黄铜矿、煤、锰矿、锑锌矿等,请回答下列问题:
(l)黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),基态Cu2+的外围电子排布图为 ______,Fe2+含有 ___个未成对电子。
(2)Mn的第三电离能比Fe的第三电离能大的原因为 ___。
(3)煤化工可得氨气、苯、甲苯等产品,氨的空间构型为 ___,甲苯分子上甲基的碳原子的杂化方式为____;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷的结构式为____(配位键用“→”表示),与氨硼烷互为等电子体的有机小分子为_____写名称)。
(4)碲化锌的晶胞结构如图1所示。
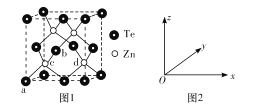
①碲化锌的化学式为____。
②图2可表示晶胞内部各原子的相对位置,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),则d的原子坐标参数为____
),则d的原子坐标参数为____
③若两个距离最近的Te原子间距离为apm,阿伏加德罗常数值为NA,则晶体密度为____g/cm3(用含有NA、a的代数式表示,不必化简)。
【答案】![]() 4 Mn的第三电离能失去的是半充满的3d5电子,而铁的第三电离能失去的是3d6电子 三角锥 sp3
4 Mn的第三电离能失去的是半充满的3d5电子,而铁的第三电离能失去的是3d6电子 三角锥 sp3 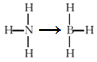 乙烷 ZnTe (
乙烷 ZnTe (![]() ,
,![]() ,
,![]() )
) ![]()
【解析】
(l)铜是29号元素,基态Cu2+的外围电子排布式为3d9;铁为26号元素,Fe2+的电子排布式为1s22s22p63s23p63d6,据此分析解答;
(2)Mn2+的电子排布式为1s22s22p63s23p63d5,Fe2+的电子排布式为1s22s22p63s23p63d6,据此分析解答;
(3)氨气分子中的N原子有3个σ键和1个孤电子对;甲苯分子上甲基的碳原子形成4个σ键,没有孤电子对;氨硼烷中N原子提供孤电子对与B形成氢键,等电子体具有相同的原子数和价电子数,据此分析解答;
(4)①根据均摊法计算解答;②如图坐标中,过前、后、左、右四个面心Te的平面将晶胞上下2等分,该平面平行坐标系中面xOy,过体内Zn原子且平行坐标系中面xOy的平面又将上半部、下半部再次平分,据此分析解答;③顶点与面心的Te原子之间距离最短,该距离等于晶胞棱长的![]() 倍,则晶胞棱长=
倍,则晶胞棱长=![]() a结合晶胞质量计算晶体密度。
a结合晶胞质量计算晶体密度。
(l)铜是29号元素,基态Cu2+的外围电子排布式为3d9,外围电子排布图为![]() ;铁为26号元素,Fe2+的电子排布式为1s22s22p63s23p63d6,含有4个未成对电子,故答案为:
;铁为26号元素,Fe2+的电子排布式为1s22s22p63s23p63d6,含有4个未成对电子,故答案为:![]() ;4;
;4;
(2)Mn的电子排布式为1s22s22p63s23p63d54s2,失去2个电子后达到3d5稳定结构,再失去1个电子较难,而Fe2+的电子排布式为1s22s22p63s23p63d6,失去一个电子后3d变成半充满的稳定状态,所以Mn的第三电离能大于Fe的第三电离能,故答案为:Mn的第三电离能失去的是半充满的3d5电子,而铁的第三电离能失去的是3d6电子;
(3)氨气分子中的N原子有3个σ键和1个孤电子对,空间构型为三角锥形;甲苯分子上甲基的碳原子形成4个σ键,杂化方式为sp3;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷中N原子提供孤电子对与B形成氢键,结构式为 ;等电子体具有相同的原子数和价电子数,与氨硼烷互为CH3CH3,名称为乙烷,故答案为:三角锥;sp3;
;等电子体具有相同的原子数和价电子数,与氨硼烷互为CH3CH3,名称为乙烷,故答案为:三角锥;sp3; ;乙烷;
;乙烷;
(4)①顶点与面心的Te原子之间距离最短,该距离等于晶胞棱长的![]() 倍,则晶胞棱长=
倍,则晶胞棱长=![]() a pm=
a pm=![]() a×10-10 cm,Te处于晶胞顶点与面心,晶胞中Te原子数目=8×
a×10-10 cm,Te处于晶胞顶点与面心,晶胞中Te原子数目=8×![]() +6×
+6×![]() =4,Zn原子处于晶胞内部,Zn原子数目=4,化学式为ZnTe,故答案为:ZnTe;
=4,Zn原子处于晶胞内部,Zn原子数目=4,化学式为ZnTe,故答案为:ZnTe;
②如图坐标中,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),过前、后、左、右四个面心Te的平面将晶胞上下2等分,该平面平行坐标系中面xOy,过体内Zn原子且平行坐标系中面xOy的平面又将上半部、下半部再次平分,针对坐标系的其它面也相同。c、d到xOy面的距离相等,即参数z关系,d到yOz面的距离是c的3倍,即参数x关系,b的参数y=0,c的参数y=
),过前、后、左、右四个面心Te的平面将晶胞上下2等分,该平面平行坐标系中面xOy,过体内Zn原子且平行坐标系中面xOy的平面又将上半部、下半部再次平分,针对坐标系的其它面也相同。c、d到xOy面的距离相等,即参数z关系,d到yOz面的距离是c的3倍,即参数x关系,b的参数y=0,c的参数y=![]() ,则d到xOz面距离是c的3倍,即y参数关系,故d的参数:x=
,则d到xOz面距离是c的3倍,即y参数关系,故d的参数:x=![]() ,y=
,y=![]() ,z=
,z=![]() ,即参数坐标为(
,即参数坐标为(![]() ,
,![]() ,
,![]() ),故答案为:(
),故答案为:(![]() ,
,![]() ,
,![]() );
);
③顶点与面心的Te原子之间距离最短,该距离等于晶胞棱长的![]() 倍,则晶胞棱长=
倍,则晶胞棱长=![]() a pm=
a pm=![]() a×10-10 cm,晶胞质量=4×
a×10-10 cm,晶胞质量=4×![]() g=
g=![]() g,晶体密度=
g,晶体密度=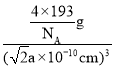 =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】化合物F(盐酸地拉普利)是一种治疗高血压的药物,其合成路线流程图如图:
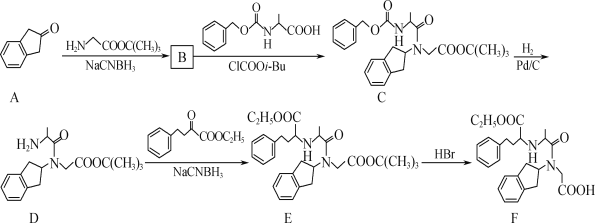
(1)D中的官能团有酰胺键、__和__(填名称)。
(2)E→F的反应类型为__。
(3)B的分子式为C15H21O2N,写出B的结构简式:__。
(4)A的一种同分异构体M同时满足下列条件,写出M的结构简式:___。
①M是一种芳香族化合物,能与NaOH溶液发生反应;
②M分子中有4种不同化学环境的氢。
(5)已知:R—X![]() R—CN
R—CN![]() R—CH2NH2。
R—CH2NH2。
写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。
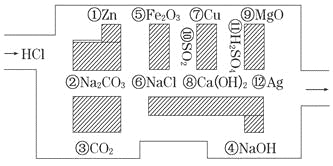
(1)请你帮助它走出迷宫:(请用图中物质前的序号连接起来表示所走的路线)______________。
(2)在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有______个,属于氧化还原反应的有____个。其中能“吃掉”盐酸的盐是__________(填物质名称),写出该反应的离子方程式_______________;
(3)在不能与盐酸反应的物质中,属于电解质的是___________(填写物质序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F为某增香剂前驱体,其合成路线如图所示(部分反应条件已略去):
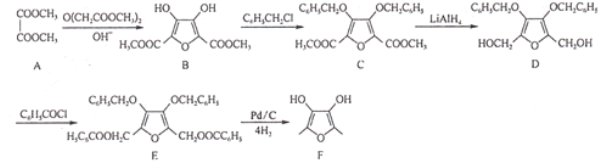
回答下列问题:
(1)A的化学名称为________。
(2)B中除羟基外,其他含氧官能团的名称为________,确定是否存在这些官能团,常用的检测手段是________(填字母)。
a.核磁共振氢谱法b.质谱法
c.红外光谱法d.X一射线衍射法
(3)由B生成C的反应类型为________,设置该步骤的目的是________。
(4)写出由D生成E的化学方程式:________。
(5)写出一种同时满足下列四个条件的B的同分异构体的结构简式:________。
a.属于芳香族化合物,不存在“—O—O—”结构;
b.lmol该物质最多消耗5molNaOH,且与足量的NaHCO3溶液反应最多可生成22.4LCO2(标准状况),
c.核磁共振氢谱显示有4种不同化学环境的氢.
(6)参照上述合成路线,写出以![]() 为原料制备
为原料制备![]() 的合成路线:________。(无机试剂任选)。
的合成路线:________。(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是
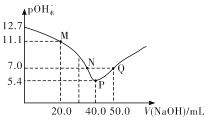
A.水的电离程度:M>PB.图中P点至Q点对应溶液中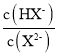 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是
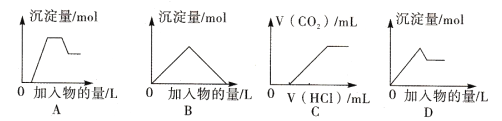
A. 图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B. 图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C. 图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D. 图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同温度下水的电离平衡曲线,已知pOH=lgc(OH),下列说法正确的是
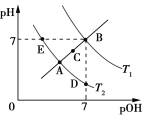
A. T1和T2的关系是:T1>T2
B. KW的关系是:B>C>A=D=E
C. A点到D点:加入少量酸可实现
D. T2时:pH=2的硫酸与pH=12的NaOH溶液等体积混合,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温25℃时,下列溶液里微粒间物质的量浓度的关系中正确的是( ):
A. 浓度0.1mol/L的NH4HSO3溶液:c(NH4+)+ c(H+)= c(OH-)+ c(HSO3-)+ c(SO32-)
B. 等体积等浓度Na2S和NaHS混合液:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+)
C. 将0.2mol/LNH3·H2O与0.1mol/LHCl等体积混合:c(Cl-)>c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
D. 在0.1mol/L的Na2CO3溶液中:c (OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnCl24H2O和CuCl22H2O的部分实验步骤如图:
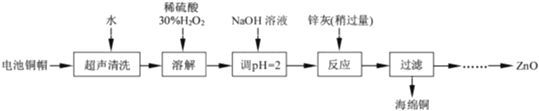
(1)从“滤液Ⅰ”中提取ZnCl24H2O的实验步骤依次为_____、_____、过滤、冰水洗涤、低温干燥
(2)“溶解Ⅱ”步骤中,发生反应的离子方程式为_____
(3)氯化铜溶液中各含铜物种的分布分数与c(Cl﹣)的关系如图。
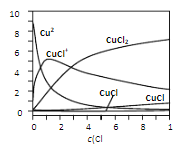
①当c(Cl﹣)=9molL﹣1时,溶液中主要的3种含铜物种浓度大小关系为_____
②在c(Cl﹣)=1molL﹣1的氯化铜溶液中,滴入AgNO3溶液,生成白色沉淀的离子方程式为_____(任写一个)。
(4)为测定产品中“CuCl22H2O”的纯度,称取0.90g样品,溶于稀硫酸并配成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量的KI充分反应,再向其中逐滴加入0.02000 molL﹣1 Na2S2O3溶液至刚好完全反应,消耗Na2S2O3溶液2500mL。已知:2Cu2++4I﹣=2CuI(白色)↓+I2;2S2O32﹣+I2═2I﹣+S4O62﹣
①样品配成溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要_____、_____
②请依据实验数据计算样品中CuCl22H2O的质量分数(写出计算过程)______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com