
【题目】甲醛(HCHO)在化工、医药、农药等的方面有广泛应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),结合如图图像回答问题。
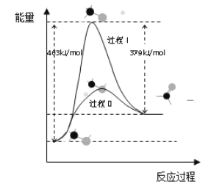
①此反应的热化学方程式是______。
②反应活化能:过程I______过程II (填“>”“=”或“<”)
③过程II温度—转化率图如图,下列说法合理的是_____。
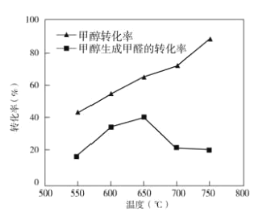
A.甲醇脱氢法制备甲醛过程无副反应发生
B.温度高于650°C催化剂烧结,活性减弱
C.及时分离产品有利于提高甲醇生成甲醛的转化率
(2)甲醛超标会危害人体健康,需对甲醛往行含量检测及污染处理。
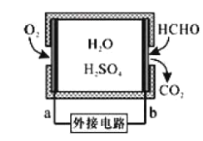
①某甲醛气体传感器的工作原理如图所示,b极的电极反应式为_________
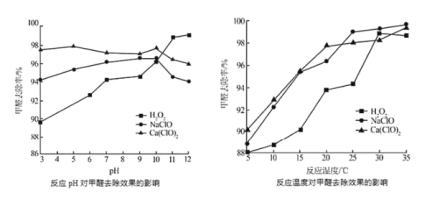
②氧化剂可处理甲醛污染,结合以如图图像分析春季(水温约15℃)应急处理甲醛污染的水源应选择的试剂为________。
(3)750K下,在恒容密闭容器中,充入的甲醇,发生反应:CH3OH(g)HCHO(g) + H2(g),若起始压强为101kPa, 达到平衡转化率为50.0%, 则反应平衡的常数Kp= ______。(用平衡分压代替平衡农度计算,分压=总压×物质的量分数,忽略其它反应)。
【答案】CH3OH (g)=HCHO (g)+H2 (g) △H= +84kJ/mol > BC HCHO-4e- + H2O= CO2+ 4H+ Ca(ClO)2 50.5kPa
【解析】
(1)①焓变=正反应活化能-逆反应活化能,所以CH3OH(g)=HCHO(g)+H2(g)的△H=463 kJ/mol-379 kJ/mol=+84kJ/mol;
②据图可知过程Ⅰ的反应活化能大于过程II;
③A.由图可知,甲醇转化率大于相应温度时甲醇转化为甲醛的转化率,所以甲醇脱氢法制备甲醛过程有副反应发生,故A错误;
B.甲醇脱氢制备甲醛反应焓变大于0,正反应为吸热反应,温度升高平衡正向移动,甲醇生成甲醛的转化率应增大,而实际上温度高于650℃时甲醇转化为甲醛的转化率降低,说明该反应的催化剂活性降低,故B正确;
C.及时分离产品,降低生成物浓度,有利于平衡正向移动,有利于提高甲醇生成甲醛的转化率,故C正确;
故答案为:BC;
(2)①由传感器工作原理图可知,HCHO发生氧化反应生成CO2,电极b为负极,电解质溶液显酸性,所以电极反应式为HCHO-4e-+H2O=CO2+4H+;
②由图可知,温度低于22℃时,Ca(ClO)2处理甲醛污染水源的去除率高,温度高于22℃时,NaClO处理甲醛污染水源的去除率高,春季水温约15℃,所以选择Ca(ClO)2处理甲醛污染的水源;
(3)恒容密闭容器中气体压强之比等于气体的物质的量之比,初始投料为甲醇,起始压强为101kPa,不妨设初始投料为101mol甲醇,平衡转化率为50.0%,则列三段式有:

所以平衡时p(CH3OH)= p(HCHO)=p(H2)=50.5=kPa,Kp=![]() =50.5kPa。
=50.5kPa。


科目:高中化学 来源: 题型:
【题目】钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用以下工艺流程可由黏土钒矿制备NH4VO3。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是___________。
(2)“酸浸氧化”中,VO+和VO2+被氧化成![]() ,同时还有___________离子被氧化。写出VO+转化为
,同时还有___________离子被氧化。写出VO+转化为![]() 反应的离子方程式___________。
反应的离子方程式___________。
(3)“中和沉淀”中,钒水解并沉淀为![]() ,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
,随滤液②可除去金属离子K+、Mg2+、Na+、___________,以及部分的___________。
(4)“沉淀转溶”中,![]() 转化为钒酸盐溶解。滤渣③的主要成分是___________。
转化为钒酸盐溶解。滤渣③的主要成分是___________。
(5)“调pH”中有沉淀生产,生成沉淀反应的化学方程式是___________。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
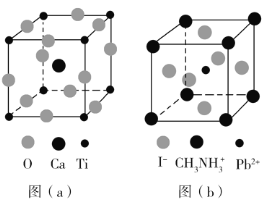
【题目】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________。
化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________;金属离子与氧离子间的作用力为__________,Ca2+的配位数是__________。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子![]() ,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱![]() 中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
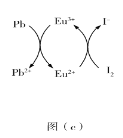
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该原理_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的。)其中,甲池为3 molL1 的AgNO3溶液,乙池为1 molL1的AgNO3溶液,A、B均为Ag 电极。实验开始先断开K1闭合K2发现电流计指针发生偏转。下列说法不正确的是
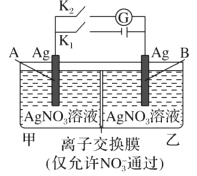
A.实验开始先断开K1,闭合K2,此时![]() 向B电极移动
向B电极移动
B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C.当电流计指针归零后,断开K2闭合K1一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南京青奥会吉祥物为“砳砳”,一种“砳砳”的外用材料是纯羊毛线,内充物为涤纶(结构简式为![]() ,下列有关说法不正确的是( )
,下列有关说法不正确的是( )
A.可用灼烧的方法区别羊毛和涤纶
B.合成涤纶的单体之一是HOCH2CH2OH
C.涤纶属于天然高分子化合物
D.羊毛和涤纶所含元素不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是

气体 | 溶液 | |
A. | H2S | 稀盐酸 |
B. | HCl | 稀氨水 |
C. | NO | 稀H2SO4 |
D. | CO2 | 饱和NaHCO3溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明SiO2为酸性氧化物的事实为( )
A.SiO2与H2SO4、HNO3不反应B.SiO2+4HF=SiF4↑+2H2O
C.SiO2+2KOH=K2SiO3+H2OD.SiO2+2C![]() Si+2CO↑
Si+2CO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A的阳离子![]() 与元素B的阴离子
与元素B的阴离子![]() 具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
A.原子序数:![]() B.离子半径:Am+>Bn-
B.离子半径:Am+>Bn-
C.原子半径:![]() D.
D.![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com