
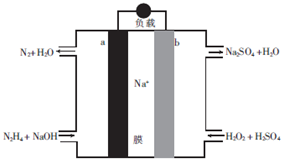
| A. | a极为电池的正极 | |
| B. | 电路中每转移6.02×1023个电子,则有1molNa+穿过膜向正极移动 | |
| C. | b极的电极反应式为H2O2+2e-=2OH- | |
| D. | 用该电池电解饱和食盐水,当阳极生成2.24L(标准状况)Cl2时,消耗肼0.1mol |
分析 根据图知,a电极上N元素化合价由-2价变为0价,所以a是负极,则b是正极,负极反应式为N2H4-4e-+2OH-=N2+3H2O,正极上电极反应式为H2O2+2e-+2H+=2H2O,
A.根据得失电子判断正负极;
B.电路中每转移6.02×1023个电子,根据电荷守恒判断;
C.酸性溶液中不能得到氢氧根离子;
D.阳极上生成标况下2.24L氯气,其物质的量是0.1mol,根据转移电子守恒计算肼的物质的量.
解答 解:根据图知,a电极上N元素化合价由-2价变为0价,所以a是负极,则b是正极,负极反应式为N2H4-4e-+2OH-=N2+3H2O,正极上电极反应式为H2O2+2e-+2H+=2H2O,
A.a电极上N元素化合价由-2价变为0价,所以a是负极,则b是正极,故A错误;
B.电路中每转移6.02×1023个电子,根据电荷守恒知,有1molNa+穿过膜向正极移动,故B正确;
C.酸性溶液中不能得到氢氧根离子,b电极反应式为H2O2+2e-+2H+=2H2O,故C错误;
D.阳极上生成标况下2.24L氯气,其物质的量是0.1mol,根据转移电子守恒得肼的物质的量=$\frac{0.1mol×2}{4}$=0.05mol,故D错误;
故选B.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,注意转移电子守恒的灵活运用,难点是电极反应式的书写.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
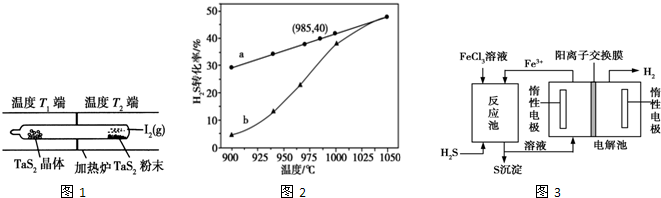
| A. | 10 | B. | 34 | C. | 44 | D. | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L该溶液中含有H2SO4的质量为9.8 g | |
| B. | 将0.1mol H2SO4溶于1L水中可得该溶液 | |
| C. | 0.5 L该溶液中氢离子的物质的量浓度为0.2 mol•L-1 | |
| D. | 从1 L该溶液中取出100 mL,则取出溶液中H2SO4的物质的量浓度为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②⑤ | C. | ①②④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  如图装置用于分离沸点相关较大的互溶液体混合物 | |
| B. | 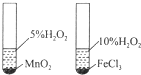 如图装置用于研究不同催化剂对反应速率的影响 | |
| C. | 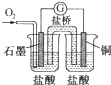 图中电流计的指针发生偏转,石墨为正极 | |
| D. |  如图装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:7 | B. | 1:5 | C. | 1:8 | D. | 2:9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com