
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请回答下列问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸,离子方程式为_______________________________________________________;Y与过量浓硝酸反应后溶液中含有的盐的化学式为____________;
(2)某溶液中含有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是___________(填编号)。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:

①Na2CO3溶液可以除油污,原因是(用离子方程式表示)________________________________;
②操作Ⅱ中沉淀的洗涤方法是___________________________________________________________
③请写出生成FeCO3沉淀的离子方程式_______________________________________________。
【答案】Fe3O4+8H+===2Fe3++Fe2++4H2O Fe(NO3)3BCCO32-+H2O![]() HCO3-+OH-向漏斗中加入蒸馏水至没过固体,让水自然流出,重复2~3次Fe2++2HCO3-=FeCO3↓+CO2↑+H2O
HCO3-+OH-向漏斗中加入蒸馏水至没过固体,让水自然流出,重复2~3次Fe2++2HCO3-=FeCO3↓+CO2↑+H2O
【解析】
(1)Fe3C在足量的空气中高温煅烧,生成有磁性的固体Y,Y为Fe3O4,溶于过量的盐酸反应生成氯化亚铁、氯化铁,化学反应方程式为Fe3O4+8HCl==2FeCl3+FeCl2+4H2O,硝酸具有强氧化性,Fe3O4与过量的浓硝酸反应生成硝酸铁,化学式为Fe(NO3)3;
(2)加入过量的NaOH,Al3+转化为偏铝酸根,Mg2+、Fe2+、Cu2+转化为氢氧化物沉淀,且氢氧化亚铁易被氧化,灼烧固体得到氧化镁、氧化铜、氧化铁,用过量的稀盐酸中,所得溶液中含有Mg2+、Fe3+、Cu2+,与原溶液相比,溶液中大量减少的阳离子是Al3+、Fe2+,故选BC;
(3)①碳酸钠溶液中碳酸根水解CO32-+H2OHCO3-+OH-,溶液呈碱性,油污主要为油脂,碱性条件下水解而除去;②FeCO3沉淀会附着其它离子,需要进行洗涤,减少杂质,具体操作为:向漏斗中加入蒸馏水至没过固体,让水自然流出,重复2~3次;③由工艺流程可知,操作I所得的滤液中主要有硫酸亚铁,加入碳酸氢铵,实质是亚铁离子与碳酸氢根离子反应,生成FeCO3, 同时生成二氧化碳、水,反应离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.⑤⑥⑦⑧B.①②③④
C.①③⑤⑥⑦⑧D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )

A. 原子半径:W>Z>Y>X
B. X的氢化物于水形成的溶液呈碱性
C. 最简单气态氢化物的热稳定性:Z>W
D. Y元素的最高价氧化物的水化物不与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列短周期元素性质的数据判断,下列说法正确的是( )
|
|
|
|
|
|
|
| |
原子半径 |
|
|
|
|
|
|
|
|
最高价或最低价 |
|
|
|
|
|
|
|
|
A. 元素④⑤形成的化合物是离子化合物
B. 元素⑦位于第二周期第V族
C. 元素①⑧形成的化合物具有两性
D. 元素③的最高价氧化物对应水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为四种短周期主族元素,且原子序数依次增大。已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最多的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。则元素符号为A_____;B____;C____;D____。D的最高价氧化物对应水化物的化学式为____;AB2的电子式为_______;结构式为____;NH3的电子式_____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是
① ②
②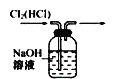
③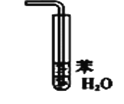 ④
④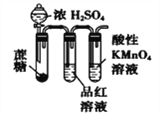
A. 用图①所示装置分离Na2CO3溶液和CH3COOC2H5的混合物
B. 装置②可用于除去Cl2中的HCl
C. 装置③可用于氯化氢气体溶于水
D. 装置④:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅直至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子核外M电子层上有3个电子,元素Y的离子Y2核外有18个电子,则这两种元素可形成的化合物为( )
A.XY2B.X2Y3C.X3Y2D.X2Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,工业上用粗MnO2(含有较多的MnO和MnCO3)样品转化为较纯净MnO2的流程如图所示:

(1)第①步反应中的硫酸能否用浓盐酸代替?____(填“能”或“否”),理由是______________。
(2)第②步操作中,氧化性强弱顺序:ClO3—___MnO2(填“>”或“<”),写出操作②中发反应的离子方程式:____;当反应中转移2mol电子时,生成的氧化产物的物质的量为___mol。
(3)工业上用MnO2为原料制取KMnO4,第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。制取K2MnO4的化学反应方程式为______,工业上不断搅拌的目的是______。
(4)二氧化锰含量可用碘量法测定,其原理为在盐酸介质中,二氧化锰能定量地将碘离子氧化成碘,以淀粉为指示剂用0.1000mol/L硫代硫酸钠标准溶液滴定碘而确定二氧化锰含量:
MnO2+4HCl+2KI![]() MnCl2+I2+2KCl+2H2O
MnCl2+I2+2KCl+2H2O
I2+2Na2S2O3![]() 2NaI+Na2S4O6
2NaI+Na2S4O6
取较为纯净的二氧化锰样品a g加入到适量的盐酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗VmLNa2S2O3溶液,则该样品中MnO2含量为______%(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Ka(HCOOH)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 混合溶液的导电性逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com