
【题目】在恒温恒容下使NH2COONH4 (s)![]() 2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
2NH3 (g)+CO2(g)达到平衡,不可以判断该反应达到化学平衡的是( )
A.V正(NH3) =2V逆(CO2)
B.密闭容器中氨气的体积分数不变
C.密闭容器中总压强不变
D.密闭容器中混合气体的密度不变
【答案】B
【解析】
A.NH3、CO2均为生成物,V正(NH3)、V逆(CO2)反应进行的方向相反,且比值等于计量数之比,可判断达到平衡状态,A错误;
B.反应中,只有NH3、CO2为气体,且生成的量之比为2:1,反应自始至终均为2:1,则密闭容器中氨气的体积分数不变时,不能判断是否达到平衡状态,B正确;
C.若反应达到平衡时,气体的总物质的量不再改变,体积为恒容,则压强不再改变,则密闭容器中总压强不变时,达到平衡状态,C错误;
D.若反应达到平衡时,气体的总物质的量不再改变,质量也不改变,体积一直不变,ρ=m/V,则密闭容器中混合气体的密度不变时,达到平衡状态,D错误;
答案为B。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
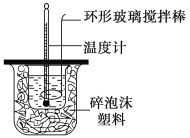
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
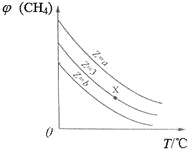
A. 该反应的焓变ΔH>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中![]() =3
=3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量为0.10mol的镁条在只含有CO2和O2的容器中燃烧(产物不含碳酸镁,不考虑C与O2的反应),反应后容器内固体物质的质量不可能为( )
A.3.2g
B.4.0g
C.4.2g
D.4.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)直接燃料电池具有启动快、效率高等优点,用二甲醚燃料电池电解甲基肼(CH3—NH—NH2)制氢的装置如图所示,其中X、Y、M、N均为惰性电极。下列说法正确的是( )
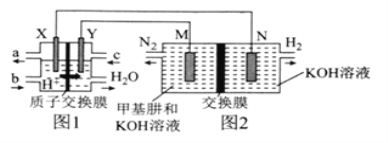
A.M极的电极反应式为CH3—NH—NH2+12OH--10e-=CO![]() +N2↑+9H2O
+N2↑+9H2O
B.图1中电解质溶液的pH减小,图2中电解质溶液的pH增大
C.图2中的交换膜是阴离子交换膜,OH-透过交换膜向N极移动
D.理论上,当生成6.72LH2时,消耗CH3OCH3的质量为2.3g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )

A.在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为92kJ
B.a曲线是加入催化剂时的能量变化曲线,催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
C.催化剂,能增大有效碰撞次数,但不能提高N2的转化率
D.该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氧化三铁俗称为磁性氧化铁,通常用作颜料、抛光剂和电讯器材等。某化学兴趣小组取磁性氧化铁进行铝热反应实验并对产物进行探究。

(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是__________。
(2)取少许反应生成的“铁块”溶于盐酸,滴加硫氰化钾溶液后溶液不变红,则______(填“能”或“不能”)说明“铁块”一定不含四氧化三铁,理由是_________。
(3)设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝,该实验所用的试剂是__________,反应的离子方程式为___________。
(4)请写出此铝热反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据乙醇的分子结构,回答下列问题:
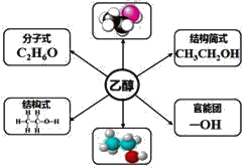
(1)乙醇属于烃的衍生物是因为______________________________________。
(2)羟基为乙醇官能团的原因是___________________________________。
(3)乙醇分子中的碳原子是否都是饱和碳原子___________(填“是”或“不是”)。
(4)乙醇分子中的共价键类型有____________________________________。
(5)乙醇分子中有______种类型的氢原子,它们的数目之比是____________。
(6)一个羟基(─OH)含有______个电子,它是否带有电荷______(填“带”或“不带”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
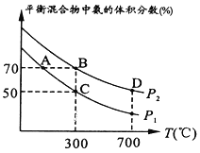
①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A.![]() 和
和![]() 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.![]() 保持不变 D.
保持不变 D.![]()
②P1_____P2 (填“<”或“>”或“=”或“不确定”,下同);反应的平衡常数:B点_______D点。
③C点![]() 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com