
【题目】将4mol SO2(g)与2molO2(g)放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+ O2(g)![]() 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
【答案】(1)c(SO2)=0.5 mol/L c(O2)=0.25mol/L c(SO3)=0.5 mol/L
(2)50%
【解析】
设平衡时SO2转化的物质的量为2a
2SO2(g) + O2(g)![]() 2SO3(g)
2SO3(g)
起始 4 mol 2 mol 0
转化 2a a 2a
平衡 4-2a 2-a 2a
4-2a+2-a+2a=5
a=1
∴平衡时各物质的物质的量分别为
n(SO2)=2 mol n(O2)=1 mol n(SO3)=2 mol
∴平衡时各物质的物质的量浓度分别为
c(SO2)=0.5 mol/L c(O2)=0.25mol/L c(SO3)=0.5 mol/L
平衡时SO2的转化率=2 mol /4 mol×100%=50%


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2![]() N2O4(正反应为放热反应) B. C(s)+CO2
N2O4(正反应为放热反应) B. C(s)+CO2![]() 2CO(正反应为吸热反应)
2CO(正反应为吸热反应)
C. N2+3H2![]() 2NH3(正反应为放热反应) D. H2S
2NH3(正反应为放热反应) D. H2S![]() H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.1molNa与![]() 完全反应生成
完全反应生成![]() 和
和![]() 的混合物,转移电子
的混合物,转移电子![]() ,生成物中离子总数为
,生成物中离子总数为![]()
B.![]() 的
的![]() 溶液中,由水电离的
溶液中,由水电离的![]() 数目为
数目为![]()
![]() 个
个
C.![]() 里含有的电子数目为
里含有的电子数目为![]()
D.62g白磷中含有P-P键的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子 PVA 可用于制滴眼露液,还可制成人工肾膜等医疗产品。由电石(CaC2)合成 PVA 的过程如下:
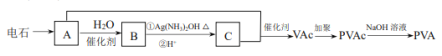
已知:VAc 的结构简式为 CH3COOCH=CH2 。
(1)电石制备 A 的化学方程式是_________________。
(2)B 与银氨溶液反应的化学方程式是_________________。
(3)PVA 的结构简式是__________________。
(4)聚乙烯醇肉桂酸酯的结构简式为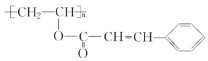 ,它是一种感光性高分子树脂。其单体可由 A 和肉桂酸(
,它是一种感光性高分子树脂。其单体可由 A 和肉桂酸( ![]() )合成,该反应的化学方程式是________________________________。
)合成,该反应的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物 H 的合成路线如下图所示:

已知:i.RCH2Br![]() R—HC=CH—R′
R—HC=CH—R′
ii.R—HC=CH—R′![]()
![]()
iii.R—HC=CH—R′![]()
 (以上R、R′、R″代表氢、烷基或芳基)
(以上R、R′、R″代表氢、烷基或芳基)
(1)A 属于芳香烃,其名称是_____________。
(2)B 的结构简式是___________________。
(3)由 C 生成 D 的化学方程式是___________________。
(4)由 E 与 I2 在一定条件下反应生成 F 的化学方程式是_____________;此反应同时生成另外一个有机副产物且与 F 互为同分异构体,此有机副产物的结构简式是_________________。
(5)试剂 b 是__________________。
(6)下列说法正确的是______________(选填字母序号)。
a.G 存在顺反异构体
b.由 G 生成 H 的反应是加成反应
c.1 mol G 最多可以与 1 mol H2 发生加成反应
d.1 mol F 或 1 mol H 与足量 NaOH 溶液反应,均消耗 2 molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烷和乙烯都能制得一氯乙烷。
(1)由乙烷制一氯乙烷的化学方程式为____________,反应类型为______________。
(2)在催化剂作用下,由乙烯制一氯乙烷的化学方程式为____________,反应类型为______________。
(3)以上两种方法中_________[填“(1)”或“(2)”]更适合用来制取一氯乙烷,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验。下列叙述中不正确的是

A.图2中的A为分液漏斗
B.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率
C.图1实验可通过观察产生气泡的快慢来比较反应速率
D.若图1实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①0.005mol·L-1FeCl3溶液和0.015mol·L-1KSCN溶液各1mL混合得到红色溶液a,均分溶液a置于b、c两支试管中;
②向b中滴加3滴饱和FeCl3溶液,溶液颜色加深;
③再向上述b溶液中滴加3滴1mol·L-1NaOH溶液,溶液颜色变浅且出现浑浊;
④向c中逐渐滴加1mol·L-1KSCN溶液2mL,溶液颜色先变深后变浅。下列分析不正确的是( )
A.实验②中增大Fe3+浓度使平衡Fe3++3SCN-![]() Fe(SCN)3正向移动
Fe(SCN)3正向移动
B.实验③中有Fe(OH)3生成
C.实验③和④中溶液颜色变浅的原因相同
D.实验②、③、④均可说明浓度改变对平衡移动的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4 溶液显酸性,关于 NaHC2O4 溶液中离子浓度关系的叙述不正确的是
A.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4)
)>c(H2C2O4)
B.c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2C2O4)
)+c(H2C2O4)
C.c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
D.c(H+)+c(H2C2O4)=c(![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com