
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
分析 A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,则A为Na;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,故D为Cl.
解答 解:A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,则A为Na;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,故D为Cl.
(1)A为Na,原子的核外电子排布式:1s22s22p63s1,
故答案为:1s22s22p63s1;
(2)B为Al元素,在周期表中的位置:第3周期第ⅢA族,Al3-、N3-离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:Al3-<N3-,
故答案为:第3周期第ⅢA族;小于;
(3)D为Cl元素,原子的外围电子排布式为:3s23p5,
故答案为:3s23p5;
(4)B、A、C最高价氧化物对应的水化物分别为Al(OH)3、NaOH、HNO3,氢氧化铝与氢氧化钠反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,氢氧化铝与硝酸反应离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;Al(OH)3+3H+=Al3++3H2O.
点评 本题考查结构性质位置关系应用,掌握核外电子排布规律与常见元素化合物性质,掌握微粒半径比较规律.


科目:高中化学 来源: 题型:实验题
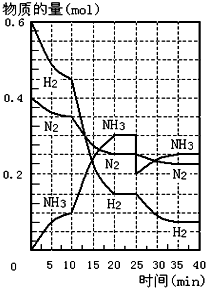 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
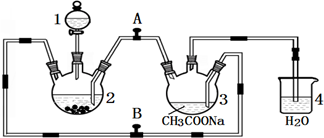
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 | B. | 2.5 mol•L-1 | C. | 5 mol•L-1 | D. | 2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
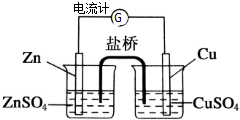 为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:
为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | B. | BaCl2 Na2SO4 (NH4)SO4 KOH | ||
| C. | AgNO3 NaCl KCl CuCl2 | D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
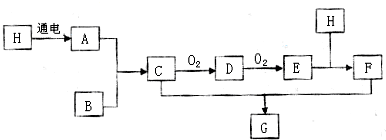
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com