
| A. | 同温下,等物质的量浓度的A12(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 | |
| B. | 向Na2SiO3溶液中滴人酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失.证明非金属性:C1>Si | |
| C. | 测定等物质的量浓度的Na2CO3和Na2SiO3溶液的pH,确定碳、硅两元素非金属性的强弱 | |
| D. | 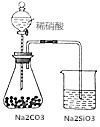 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 如图锥形瓶中有气体产生,烧杯中液体变浑浊,可证明N、C、Si非金属性依次减弱 |
分析 A.等物质的量浓度的A12(SO4)3比MgSO4溶液,金属离子的浓度不同;
B.比较非金属性,应根据元素对应的最高价氧化物的水化物的酸性比较;
C.最高价氧化物的水化物的酸性越强,其酸根阴离子的水解程度越小;
D.能根据元素最高价含氧酸的酸性强弱判断元素的非金属性强弱;
解答 解:A.等物质的量浓度的A12(SO4)3比MgSO4溶液,金属离子的浓度不同,不能根据溶液的pH大小判断离子的水解程度,即不能判断其氢氧化物的碱性强弱,所以不能说明镁比铝的金属性强,故A错误;
B.向Na2SiO3溶液中滴入酚酞,溶液变红,说明Na2SiO3水解呈碱性,为强碱弱酸盐,再滴加稀盐酸,溶液红色变浅直至消失,说明盐酸酸性比硅酸强,但不能比较Si、Cl的非金属性强弱,应根据元素对应的最高价氧化物的水化物的酸性比较,故B错误;
C.盐溶液水解程度越大,对应酸的酸性越弱;测同温同浓度Na2CO3和Na2SiO3水溶液的pH,碳酸钠溶液PH大于硅酸钠溶液,说明硅酸酸性小于碳酸,证明碳非金属性大于硅,故C正确;
D.能根据元素最高价含氧酸的酸性强弱判断元素的非金属性强弱,由强酸制弱酸原理可知,酸性:硝酸大于碳酸,碳酸大于硅酸,所以可证明N、C、Si非金属性依次减弱,故D正确.
故选CD.
点评 本题考查化学实验方案的评价,涉及氧化还原、盐类水解、氧化性强弱以及非金属性的比较等知识,侧重基础知识的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 某汽车公司首次发表了Na-S电池的有关报道.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )
某汽车公司首次发表了Na-S电池的有关报道.其结构如图所示,电池反应为2Na+$\frac{n}{8}$S8$?_{充电}^{放电}$Na2Sn.下列说法不正确的是( )| A. | 充电时熔钠电极与电源的负极相连 | |
| B. | 放电时Na+向正极移动 | |
| C. | 放电时熔钠电极作电池的正极 | |
| D. | 充电时阳极反应式为8Sn2--16e-═nS8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 | |
| B. | 定容摇匀后发现液面下降,不应再加蒸馏水 | |
| C. | 称量时托盘上要垫上干净的称量纸 | |
| D. | 移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的盐酸滴定V mL同浓度的NH3•H2O时得到的滴定曲线.
水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的盐酸滴定V mL同浓度的NH3•H2O时得到的滴定曲线.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:
将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用镊子夹取金属钠固体,切割取用后剩余的钠必须放回原试剂瓶中 | |
| B. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| C. | 金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 | |
| D. | 在分液操作中,当试液分层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com