
| A. | 元素的非金属性顺序为a>b | |
| B. | a和c形成的离子化合物中可能含有共价键 | |
| C. | d的最高价氧化物对应的水化物可溶于c的最高价氧化物对应水化物的水溶液 | |
| D. | 五种元素离子半径最小的是d |
分析 原子序数依次增大的短周期元素a、b、c、d,它们的最外层电子数分别为6、7、1、3,a、b为非金属元素,c、d为金属元素,又a、b、c、d形成的简单离子与氖原子电子层结构相同,则a、b位于第二周期,c、d位于第三周期,a为O、b为F、c为Na、d为Al元素,然后结合元素周期律知识进行解答.
解答 解:原子序数依次增大的短周期元素a、b、c、d,它们的最外层电子数分别为6、7、1、3,a、b为非金属元素,c、d为金属元素,又a、b、c、d形成的简单离子与氖原子电子层结构相同,则a、b位于第二周期,c、d位于第三周期,a为O、b为F、c为Na、d为Al元素,
A.O、F两种元素中非金属性最强的是F,则元素的非金属性顺序为a<b,故A错误;
B.O、Na可形成Na2O2,为含有共价键的离子化合物,故B正确;
C.d的最高价氧化物对应的水化物为氢氧化铝,c的最高价氧化物对应水化物为氢氧化钠,Al(OH)3可溶于NaOH溶液,故C正确;
D.四种元素离子半径由大到小的顺序为:O2->F->Na+>Al3+,离子半径最小的是Al3+,故D正确;
故选A.
点评 本题考查了原子结构与元素周期律的综合应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 溶液中只含Fe3+、SO42-、Cl- | |
| B. | 溶液中只含Cu2+、SO42- | |
| C. | 需要利用焰色反应才能确定有无Na+ | |
| D. | 溶液中肯定没有I-,但无法确定有无Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
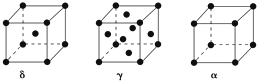
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
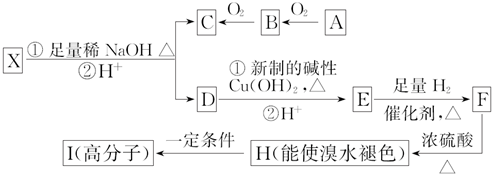
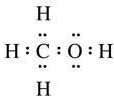 ;I的结构简式为
;I的结构简式为 .
.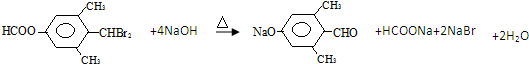 ;
; 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
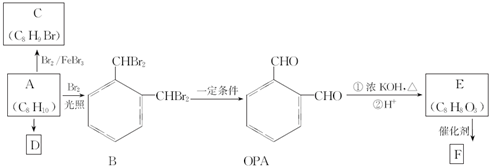
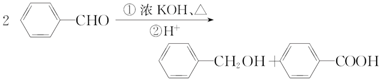
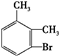
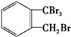 .
. 、
、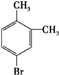 .
.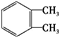 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$ $→_{△}^{CH_{3}CH_{2}OH、浓硫酸}$
$→_{△}^{CH_{3}CH_{2}OH、浓硫酸}$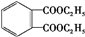 .
.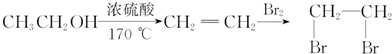
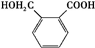 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$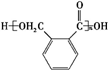 +(n-1)H2O.
+(n-1)H2O.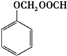 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
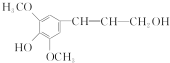
| A. | 芥子醇的分子式为C11H14O4 | |
| B. | 芥子醇分子中所有碳原子可能在同一平面上 | |
| C. | 1 mol该化合物在一定条件下最多可与2molNaOH反应 | |
| D. | 芥子醇在一定条件下能发生氧化、取代、加成、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
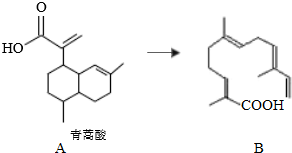
| A. | 青蒿酸的分子式为C15H20O2 | |
| B. | 1mol青蒿酸最多可与3molH2加成 | |
| C. | 青蒿酸与B互为同分异构体 | |
| D. | 苯环上连有-CHO和-OH、分子中有6种不同化学环境氢的青蒿酸的同分异构体只有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com