
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是
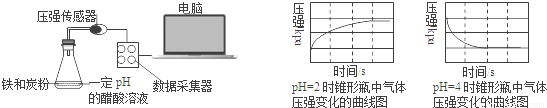
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe﹣2e﹣=Fe2+
科目:高中化学 来源:2015-2016学年江西省高二上期中测试化学试卷(解析版) 题型:选择题
250 ℃和1.01×105 Pa时,反应2N2O5(g) == 4NO2(g)+O2(g) ΔH=+56.76 kJ/mol,自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中必修化学试卷(解析版) 题型:选择题
在无色酸性溶液中能大量共存的离子组是
A.NH4+、Fe3+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省泰州市姜堰区高二上学期期中必修化学试卷(解析版) 题型:选择题
下列四种物质的溶液,其中一种与其它三种都能发生离子反应,这种物质是
A.H2SO4 B.KOH C.BaCl2 D. Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016届山东省邹城市高三上学期10月月考化学试卷(解析版) 题型:选择题
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abcd D.acd
查看答案和解析>>
科目:高中化学 来源:2016届福建省晨曦、冷曦、正曦、岐滨四校高三第二次联考理综化学试卷(解析版) 题型:填空题
(16分)氮氧化合物是目前造成大气污染的主要气体。NO在空气中存在如下反应:
2NO(g) + O2(g)  2NO2(g) ΔH
2NO2(g) ΔH
(1)上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示):
①2NO(g)  N2O2(g) ΔH1<0 ②__________________________
N2O2(g) ΔH1<0 ②__________________________
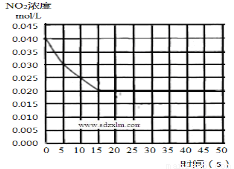
(2)在某温度下的一密闭容器中充入一定量的NO2,测得NO2的浓度随时间的变化曲线如下图所示,前5 秒内的O2的平均生成速率为___________________mol•L-1•s-1,该条件下反应:2NO + O2 2NO2的化学平衡常数数值为_________________,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO2的化学平衡常数数值为_________________,平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,则:
2NO(g) + O2(g)  2NO2(g) ΔH______0(填“<”或 “>”);
2NO2(g) ΔH______0(填“<”或 “>”);
(3)2NO(g) + O2(g)  2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)
2NO2(g)的两步反应中,反应①的反应速率数值较大,是一个快反应,会快速建立平衡状态,而反应②是一个慢反应,则决定反应2NO(g) + O2(g)  2NO2(g)反应速率的是反应__________(填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)
2NO2(g)反应速率的是反应__________(填”①”或“②”)。对(2)中反应体系升高温度的过程中,发现2NO(g) + O2(g)  2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________(反应未使用催化剂)。
2NO2(g)的反应速率变慢,结合该反应的两步反应过程分析可能的原因__________________________(反应未使用催化剂)。
(4)若(2)中反应体系,反应开始时使用催化剂,请在(2)的图中画出该反应体系反应进程可能的曲线。
(5)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如右图示,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,电解池阴极反应为__________________。

查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省绥化市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列说法错误的是
A.硝酸能溶解除金、铂外的大多数金属
B.汽车尾气中含有NO和CO
C.浓氨水可检验氯气管道漏气
D.制取二氧化氮时,常用水吸收尾气
查看答案和解析>>
科目:高中化学 来源:2016届湖南省益阳市高三上学期第三次模拟化学试卷(解析版) 题型:实验题
(12分)某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率。
饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%

甲方案:利用甲、乙装置测定饱和食盐水的电解率,
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的实验现象:__________________
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为 连_______(填A、B、C、等导管口),则洗气瓶a中发生反应的离子方程式为___________________
乙方案:利用甲、丙装置测定饱和食盐水的电解率,
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率,
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①.一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则该干燥装置应与 口连接
a.A b.B c.D d.E
②.另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?请说明理由
丙方案:只利用甲装置测定饱和食盐水的电解率。
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,求饱和食盐水的电解率
(假设电解前后溶液体积不变,饱和食盐水密度约为1.33 g/mL,溶解度为36.0g)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com