
| A. | 粗盐在空气中易潮解 | B. | NH4Cl与ZnCl2用于金属焊接中除锈 | ||
| C. | 用热纯碱溶液去油污 | D. | 蒸干并灼烧FeCl3溶液得到Fe2O3 |
分析 A、粗盐中含氯化镁和氯化钙,均易潮解;
B、NH4Cl与ZnCl2均为强酸弱碱盐,在溶液中水解显酸性;
C、纯碱为强碱弱酸盐,水解显碱性;
D、氯化铁水解为氢氧化铁和盐酸,而盐酸易挥发,据此分析蒸干后的产物.
解答 解:A、粗盐中含氯化镁和氯化钙,均易吸水潮解,故和盐类的水解无关,故A正确;
B、NH4Cl与ZnCl2均为强酸弱碱盐,在溶液中水解显酸性,故能和铁锈反应从而除去铁锈,故和盐类的水解反应有关,故B错误;
C、纯碱为强碱弱酸盐,水解显碱性,而油脂属于酯类,能在碱性条件下水解从而除去,故和盐类的水解有关,故C错误;
D、氯化铁水解为氢氧化铁和盐酸:FeCl3+3H2O?Fe(OH)3+3HCl,而盐酸易挥发,故蒸干时盐酸挥发导致浓度降低,则水解平衡右移,氯化铁最终水解为Fe(OH)3,灼烧时Fe(OH)3分解为Fe2O3,故整个过程和盐类的水解有关,故D错误.
故选A.
点评 本题考查了盐类水解的应用,难度不大,应注意的是粗盐易潮解的原因和盐类的水解无关,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 缩小体积加压 | B. | 扩大体积减压 | C. | 增加E的浓度 | D. | 降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯的加聚反应产物 | |
| B. | 乙醇的消去反应产物 | |
| C. | 甲烷与氯气的取代反应中的有机产物 | |
| D. | 苯与氢气按1:3加成反应的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用排水法收集铜粉与浓硝酸反应产生的NO2 | |
| B. | 用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液 | |
| C. | 用酸性KMnO4溶液验证草酸的还原性 | |
| D. | 用饱和NaHCO3溶液除去Cl2中混有的HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
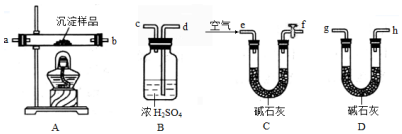
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
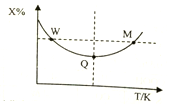 在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2molX和1molY发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | Q点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数增大 | |
| C. | W点X的正反应速率等于M点X的正反应速率 | |
| D. | 平衡时,X的转化率大于Y的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com